-
已知铍(Be)与铝的性质相似.则下列判断正确的是( )
A.铍遇冷水剧烈反应
B.氧化铍的化学式为Be2O3
C.氢氧化铍能与氢氧化钠溶液反应
D.氯化铍水溶液显中性
难度: 简单查看答案及解析
-
下列物质的用途利用其物理性质的是
A.草酸用作还原剂 B.生石灰用作干燥剂
C.苯用作萃取剂 D.铁粉用作抗氧化剂
难度: 简单查看答案及解析
-
下列关于氨分子的化学用语错误的是
A.化学式:NH3 B.电子式:
C.结构式:
D.比例模型:

难度: 中等查看答案及解析
-
铯(Cs)在自然界中只有一种稳定同位素
Cs,核泄漏事故中会产生人工放射性同位素
Cs、
Cs。下列有关说法正确的是
A.铯元素的相对原子质量约为133 B.
Cs、
Cs的性质相同
C.
Cs的电子数为79 D.
Cs、
Cs互为同素异形体
难度: 中等查看答案及解析
-
有关氮原子核外p亚层中的电子的说法错误的是( )
A.能量相同 B.电子云形状相同
C.自旋方向相同 D.电子云伸展方向相同
难度: 简单查看答案及解析
-
有关元素性质递变规律的叙述正确的是
A.同主族元素从上到下,单质的熔点逐渐降低
B.同主族元素从上到下,氢化物的熔点逐渐降低
C.同周期元素(除零族元素外)从左到右,简单离子半径逐渐减小
D.同周期元素(除零族元素外)从左到右,原子失电子能力逐渐减弱
难度: 中等查看答案及解析
-
有关化学键和晶体的叙述中正确的是( )
A.分子晶体中,分子间作用力越大分子越稳定
B.分子晶体都是由共价分子构成的
C.离子晶体中可能含有共价键
D.原子晶体中只存在非极性键
难度: 简单查看答案及解析
-
下列反应所得溶液中只含一种溶质的是
A.Fe2(SO4)3溶液中加入过量Fe粉 B.A1(OH)3中加入过量NaOH溶液
C.浓H2SO4中加入过量Cu片,加热 D.Ca(C1O)2溶液中通入过量CO2
难度: 中等查看答案及解析
-
从海带中提取碘元素的步骤中,选用的实验仪器不能都用到的是
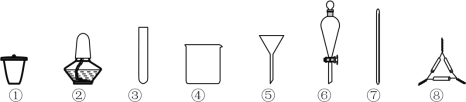
A.海带灼烧灰化,选用①②⑧ B.加水浸泡加热,选用②④⑦
C.过滤得到滤液,选用④⑤⑦ D.萃取和分液,选用③④⑥
难度: 中等查看答案及解析
-
常温下,以下试剂不能用来鉴别SO2和H2S的是
A.滴有淀粉的碘水 B.氢氧化钠溶液
C.硫酸铜溶液 D.品红溶液
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,关于a g亚硫酸钠晶体(Na2SO3•7H2O)的说法中正确的是
A.含Na+数目为
NA B.含氧原子数目为
NA
C.完全氧化SO32-时转移电子数目为
NA D.含结晶水分子数目为
NA
难度: 中等查看答案及解析
-
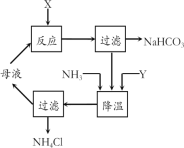
如图所示的方案可以降低铁闸门的腐蚀速率。下列判断正确的是( )

A.若X为导线,Y可以是锌
B.若X为导线,铁闸门上的电极反应式为Fe-2e-=Fe2+
C.若X为直流电源,铁闸门做负极
D.若X为直流电源,Y极上发生还原反应
难度: 中等查看答案及解析
-
CH2=CH-CH=CH2通过一步反应不能得到的物质是
A.
B.
C.
D.CO2
难度: 中等查看答案及解析
-
已知:Br+H2 HBr+H,其反应的历程与能量变化如图所示,以下叙述正确的是
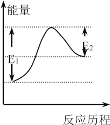
A.该反应是放热反应
B.加入催化剂,E1-E2的差值减小
C.H-H的键能大于H-Br的键能
D.因为E1>E2,所以反应物的总能量高于生成物的总能量
难度: 中等查看答案及解析
-
室温下,有pH均为9,体积均为10 mL的NaOH溶液和CH3COONa溶液,下列说法正确的是
A.两种溶液中的c(Na+)相等
B.两溶液中由水电离出的c(OH-)之比为10-9/10-5
C.分别加水稀释到100mL时,两种溶液的pH依然相等
D.分别与同浓度的盐酸反应,恰好反应时消耗的盐酸体积相等
难度: 中等查看答案及解析
-
人体血液中存在的平衡:H2CO3
HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随
变化关系如表所示,则下列说法中错误的是
1.0
17.8
20.0
22.4
pH
6.10
7.35
7.40
7.45
A.pH=7的血液中,c(HCO3-)>c(H2CO3)
B.正常体温下人体发生碱中毒时,c(H+)•c(OH-)变大
C.人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒
D.
=20.0时,H2CO3的电离程度小于HCO3-的水解程度
难度: 中等查看答案及解析
-
某溶液中可能含有K+、NH4+、Ba2+、SO42-、I-、Cl-、NO3-中的几种,将此溶液分成两等份,进行如下实验:
①在一份溶液中加入足量NaOH,加热,可收集到标准状态下的气体1.12 L;
②在另一份溶液中加入足量Ba(NO3)2溶液,有白色沉淀产生,过滤得到沉淀2.33 g;
③在②的滤液中加入足量AgNO3溶液,又有4.7 g沉淀产生。
有关该溶液中离子种类(不考虑H+和OH-)的判断正确的是
A.溶液中至少有2种阳离子 B.只能确定溶液中NH4+、SO42-是否存在
C.溶液中最多有4种阴离子 D.溶液中不可能同时存在K+和NO3-
难度: 中等查看答案及解析
-
在恒容密闭容器中,反应3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g)达到平衡,保持温度不变,加入少量水蒸气,体系重新达到平衡,下列说法正确的是
A.水蒸气的体积分数增大 B.氢气的浓度增大
C.平衡常数变大 D.铁的质量增大
难度: 中等查看答案及解析
-
在体积都为1 L、pH都等于2的盐酸和醋酸溶液中,分别投入等量的锌粒。下图所示可能符合客观事实的是
A.
 B.
B.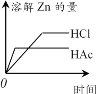
C.
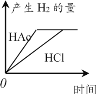 D.
D.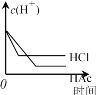
难度: 中等查看答案及解析




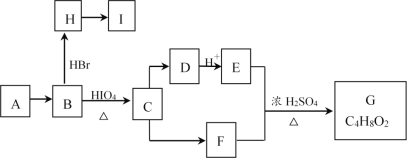
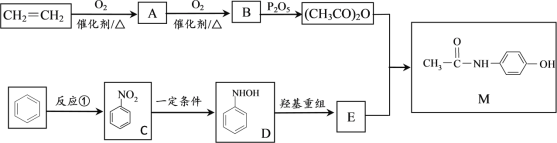
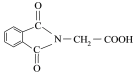 )是重要的化工中间体,工业上以邻二甲苯和甘氨酸(NH2-CH2-COOH)为原料通过一系列的反应制取该化合物,请参照上述流程的相关信息,写出最后一步反应的化学方程式。_____________________
)是重要的化工中间体,工业上以邻二甲苯和甘氨酸(NH2-CH2-COOH)为原料通过一系列的反应制取该化合物,请参照上述流程的相关信息,写出最后一步反应的化学方程式。_____________________