-
下列有关叙述错误的是( )
A.中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
B.陶瓷、水泥和光导纤维均属于硅酸盐材料
C.“煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气
D.石油裂解、煤的干馏、玉米制醇、蛋白质的变性都是化学变化
难度: 简单查看答案及解析
-
81号元素所在周期和族是
A.第六周期IVA 族 B.第六周期IIIB族 C.第七周期0族 D.第六周期IIIA族
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.将BaSO4放入水中不能导电,所以BaSO4是非电解质
B.氨溶于水得到的氨水能导电,所以氨水是电解质
C.固态的离子化合物不能导电,熔融态的离子化合物能导电
D.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
难度: 简单查看答案及解析
-
下列有关物质性质的比较,错误的是( )
A.溶解度(25℃):小苏打 < 苏打 B.沸点:H2Se>H2S>H2O
C.密度:溴乙烷 > 水 D.碳碳键键长:乙烯 < 苯
难度: 简单查看答案及解析
-
V mL Al2(SO4)3溶液中含Al3+ a g,取
mL溶液稀释到4V mL,则稀释后溶液中SO42-的物质的量浓度是( )
A.
mol·L-1 B.
mol·L-1
C.
mol·L-1 D.
mol·L-1
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A.1mol冰醋酸和1mol乙醇经催化加热反应可生成H2O分子数为NA
B.常温常压下,将15g NO和8g O2混合,所得混合气体分子总数小于0.5NA
C.标准状况下,2.24 L的CCl4中含有的C—Cl键数为0.4NA
D.6.8g熔融态KHSO4中含有0.1NA个阳离子
难度: 简单查看答案及解析
-
下列物质的制备方法正确的是( )
A.实验室用1体积酒精和3体积浓度为6mol/L的硫酸制乙烯
B.用镁粉和空气反应制备Mg3N2
C.2mL10%的NaOH溶液中滴加2%的CuSO4溶液5滴得新制Cu(OH)2悬浊液
D.用电解熔融氯化铝的方法制得单质铝
难度: 简单查看答案及解析
-
在相同温度下等体积、等物质的量浓度的4种稀溶液:①Na2SO4②H2SO3③NaHSO3 ④Na2S,所含带电微粒的数目由多到少的顺序是 ( )
A.①=④>③=② B.①=④>③>② C.①>④>③>② D.④>①>③>②
难度: 中等查看答案及解析
-
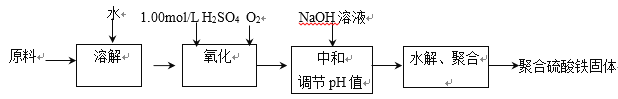
下图是侯氏制碱法在实验室进行模拟实验的生产流程示意图,则下列叙述正确的是( )
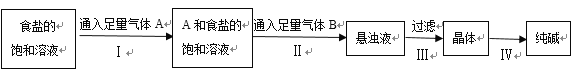
A.第Ⅱ步的离子方程式为Na++NH3+H2O+CO2→NaHCO3↓+NH4+
B.第Ⅲ步得到的晶体是Na2CO3•10H2O
C.A气体是CO2,B气体是NH3
D.第Ⅳ步操作的过程主要有溶解、蒸发、结晶
难度: 中等查看答案及解析
-
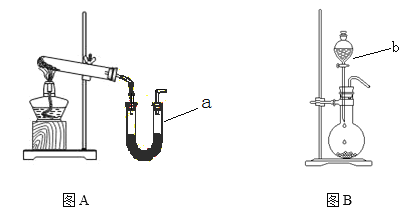
下列实验原理或操作,正确的是( )
A.用广泛pH试纸测得 0.1mol/L NH4Cl溶液的pH=5.2
B.酸碱中和滴定时锥形瓶用蒸馏水洗涤后,再用待测液润洗后装液进行滴定
C.将碘水倒入分液漏斗,加入适量苯振荡后静置,从分液漏斗放出碘的苯溶液
D.在溴化钠中加入少量的乙醇,再加入2倍于乙醇的1﹕1的硫酸制取溴乙烷
难度: 简单查看答案及解析
-
研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )

A.d为石墨,电流从d流入导线进入铁片
B.d为铜片,铜片上电极反应为:O2 + 2H2O + 4e → 4OH–
C.d为锌块,铁片不易被腐蚀
D.d为镁片,铁片上电极反应为:2H+ + 2e → H2↑
难度: 简单查看答案及解析
-
室温下,某溶液中含有Na+、H+、Fe3+、HCO3-、OH-、I-中的几种,水电离出的c(H+)=1×l0-13 mol/L。当向该溶液中缓慢通入一定量的Cl2后,溶液由无色变为黄色。下列分析正确的是( )
A.溶液的pH=1或13 B.溶液中一定没有Fe3+,Na+
C.溶液中阴离子有I-,不能确定HCO3- D.当Cl2过量,所得溶液只含有两种盐
难度: 中等查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
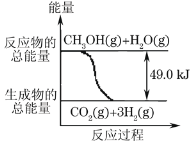
①CH3OH(g)+H2O(g)→CO2(g)+3H2(g) -49.0kJ
②CH3OH(g)+
O2(g)→CO2(g)+2H2(g)+192.9kJ
下列说法正确的是( )
A.1molCH3OH完全燃烧放热192.9kJ
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+
O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ
难度: 中等查看答案及解析
-
下表中对应关系正确的是( )
A
CH3CH3+Cl2
CH3CH2Cl+HCl
CH2=CH2+HCl→CH3CH2Cl
均为取代反应
B
由油脂得到甘油;由卤代烃制醇
均发生了水解反应
C
Cl2+2Br‾→2Cl‾+Br2;Zn+Cu2+→Zn2++Cu
均为单质被还原的置换反应
D
2Na2O2+2H2O→4NaOH+O2↑;
2F2+2H2O→4HF+ O2
均为水作还原剂的氧化还原反应
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
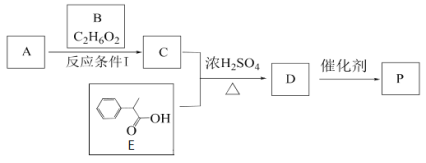
以下物质检验的结论可靠的是( )
A.往溶液中加入溴水,出现白色沉淀,说明含有苯酚
B.向含酚酞的氢氧化钠溶液中加入溴乙烷,加热后红色变浅,说明溴乙烷发生了水解
C.在制备乙酸乙酯后剩余的反应液中加入碳酸钠溶液,产生气泡,说明还有乙酸剩余
D.将乙醇和浓硫酸共热后得到的气体通入溴水中,溴水褪色,说明生成了乙烯
难度: 简单查看答案及解析
-
在给定条件下,下列加点的物质在化学反应中完全消耗的是
A.标准状况下,将1g铝片投入20mL 18.4mol/L的硫酸中
B.常温下,向100mL 3mol/L的硝酸中加入6.4g铜
C.在适当温度和催化剂作用下,用2molSO2和1molO2合成SO3
D.将含有少量H2O(g)的H2通入盛有足量Na2O2容器中并不断用电火花点燃
难度: 中等查看答案及解析
-
如图表示反应 N2(g)+3H2(g)
2NH3(g)+Q的正反应速率随时间的变化情况,试根据如图曲线判断下列说法可能正确的是( )
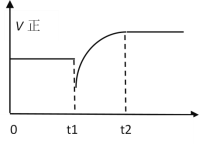
A.t1时只减小了压强
B.t1时只降低了温度
C.t1时只减小了NH3的浓度,平衡向正反应方向移动
D.t1时减小N2浓度,同时增加了NH3的浓度
难度: 中等查看答案及解析
-
某含铬Cr2O72- 废水用硫酸亚铁铵[FeSO4·(NH4)2 SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n molFeO·FeyCrxO3(Cr化合价+3价) 。不考虑处理过程中的实际损耗,下列叙述错误的是( )
A.消耗硫酸亚铁铵的物质的量为n(2-x)mol B.处理废水中Cr2O72- 的物质的量为
mol
C.反应中发生转移的电子为3nx mol D.在FeO·FeyCrxO3中3x=y
难度: 中等查看答案及解析
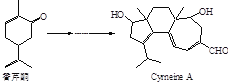
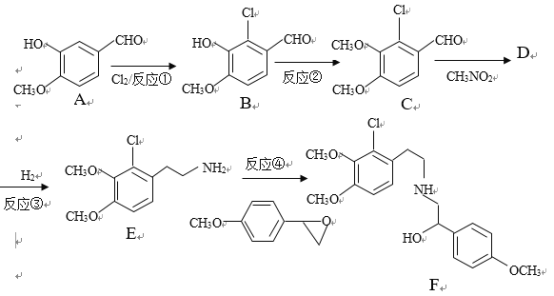
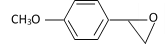 很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式_____________。
很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式_____________。