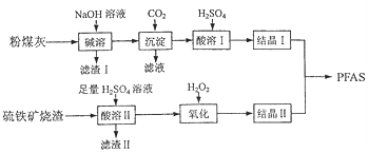
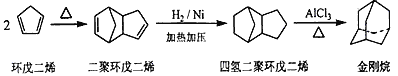
-
已知BrCl能发生下列反应:nBrCl+2M=MCln+MBrn(M为+n价的金属元素),BrCl+H2O=HCl+HBrO,以下推论不正确的是( )
A.BrCl具有和卤素单质相似的化学性质
B.BrCl和M反应时,BrCl只作氧化剂
C.BrCl和NaOH溶液反应生成NaCl、NaBrO两种盐
D.将BrCl跟FeSO4溶液反应,溶液会变成无色
难度: 中等查看答案及解析
-
化学是以一门实验为基础的自然科学,许多实验有丰富的颜色变化,有关实验的颜色变化有错误的是
A.向FeSO4和KSCN的混合溶液中滴加少量的新制氯水,溶液由浅绿色变为红色
B.向FeSO4中滴加NaOH溶液,沉淀的颜色由白色迅速变为灰绿色,最后变为红褐色
C.向Fe(NO3)2溶液中滴加稀硫酸,能使溶液由浅绿色变为棕黄色
D.向FeSO4中滴加少量酸性高锰酸钾溶液,能使溶液由浅绿色变为浅紫红色
难度: 中等查看答案及解析
-
既可以通过单质与单质化合,也可以通过溶液中的复分解反应来制得的化合物是
A.FeCl2 B.FeCl3 C.Fe2O3 D.Al2O3
难度: 简单查看答案及解析
-
下列叙述不正确的是:①Fe与S混合加热生成FeS ②Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 ③少量的铜与浓硝酸反应一定有一氧化氮生成 ④FeCl3溶液能与Cu反应,可用于蚀刻印刷电路
A.①③ B.①② C.②④ D.②③
难度: 简单查看答案及解析
-
下列数据是对应物质的熔点(℃),据此做出的下列判断中错误的是( )
Na2O
NaCl
AlF3
AlCl3
920
801
1291
190
BCl3
Al2O3
CO2
SiO2
-107
2073
-57
1723
A.铝的化合物形成的晶体中有的是离子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
难度: 简单查看答案及解析
-
下列化合物中,在常温常压下以液态形式存在的是
A.乙醇 B.新戊烷 C.丙烯 D.正丁烷
难度: 简单查看答案及解析
-
下列化合物的分子中,所有原子都处在同一平面的有
A.乙烷 B.甲烷 C.二氯甲烷 D.四氯乙烯
难度: 简单查看答案及解析
-
下列反应中,属于取代反应的是
①CH3CH=CH2+Br2
CH3CHBrCH2Br
②CH3CH2OH
CH2CH2+H2O
③CH4+Cl2
CH3Cl+HCl
④C6H6+HNO3
C6H5NO2+H2O
A.①② B.③④ C.①③ D.②④
难度: 简单查看答案及解析
-
将表面已经完全钝化的铝条插入下列溶液中,不会发生反应的是
A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠
难度: 简单查看答案及解析
-
下面的排序不正确的是
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.离子键由强到弱:NaF>NaCl>NaBr>NaI
难度: 简单查看答案及解析
-
下列关于Cl、N、S等非金属元素化合物的说法正确的是( )
A.漂白粉的成分仅为次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH溶液处理NO2和HCl废气
D.Al2(SO4)3可除去碱性废水中的悬浮颗粒
难度: 简单查看答案及解析
-
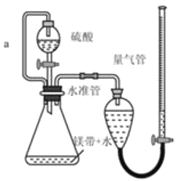
对实验Ⅰ~Ⅳ的实验现象预测正确的是

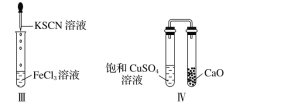
A.实验Ⅰ:液体分层,下层呈无色
B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C.实验Ⅲ:试管中有红色沉淀生成
D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
难度: 中等查看答案及解析
-
从下列事实所列出的相应结论正确的是
实验事实
结论
A
Cl2的水溶液可以导电
Cl2是电解质
B
SO2通入硝酸钡溶液出现白色沉淀
BaSO3不溶于强酸
C
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀
结合H+的能力:CO32-<AlO2-
D
常温下白磷可自燃,而氮气须在放电时才与氧气反应
非金属性:P>N
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
向盛有Cl2的六个集气瓶甲、乙、丙、丁、戊、己中各注入下列液体中的一种,经过振荡,现象如下图所示,则甲、乙、丙、丁、戊、己注入的液体分别是
①AgNO3溶液;②NaOH溶液;③水;④淀粉-KI溶液;⑤FeCl2与KSCN混合液;⑥NaBr溶液
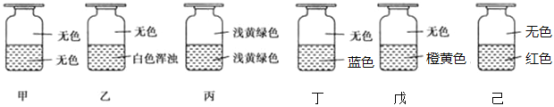
A.④①②⑥⑤③ B.⑥①③④②⑤ C.⑥③②④①⑤ D.②①③④⑥⑤
难度: 简单查看答案及解析
-
“飘尘”是物质燃烧时产生的颗粒状漂浮物,颗粒和小(直径小于10-7m),不易沉降(可漂浮数小时甚至数年),它与空气中的SO2、O2 接触时,SO2会转化为SO2:会转化为SO3,使空气酸度增加。飘尘所起的主要作用与下列变化中硫酸的作用相似是
A.胆矾中加浓硫酸
B.浓硫酸与木炭共热
C.乙醇与浓硫酸共热
D.浓硫酸滴到蔗糖中制“黑面包”
难度: 简单查看答案及解析
-
以下相关实验结论中,正确的是
A.浓度为0.1mol/L-1 Fe2(SO4)3溶液,温度升高,溶液的pH降低
B.一元酸与一元碱恰好完全反应后的溶液一大存在:c(H+)= c(OH-)
C.将相同浓度AlCl3、NH3∙H2O、Ba(OH)2三种物质的溶液等体积混合时没有沉淀生成
D.在所有能够溶解Al(OH)3的溶液中,Fe3+,ClO-,Cl-,Ca2+一定能够大量共存
难度: 中等查看答案及解析
-
已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均已单键结合,下列关于晶体说法正确的是
A.C3N4晶体是分子晶体
B.C3N4晶体中,C-N键的键长比金刚石中C-C键的键长要长
C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D.C3N4晶体中微粒间通过离子键要长
难度: 简单查看答案及解析
-
β−月桂烯的结构如图所示,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有( )
A.2种 B.3种 C.4种 D.6种
难度: 中等查看答案及解析
-
把一块镁铝合金投入到1mol/L盐酸里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成的物质的量随加入NaOH溶液体积的变化如下图A所示。则有关说法中不正确的是
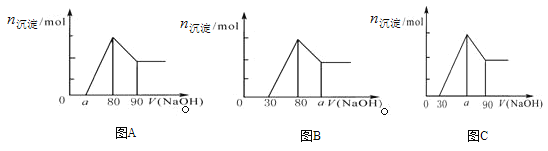
A.a的取值范围为0⩽a<50
B.
的最大值为2.5
C.若将关系图改为B图时,则a的取值范围为80<a<90
D.若将关系图改为C图时,则a的取值范围为75<a<90
难度: 困难查看答案及解析