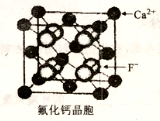
-
化学与生产、生活息息相关,下列叙述错误的是
A. “真金不怕火炼”说明有些金属(例如金)即使在高温下也不与氧气发生反应
B. 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
C. 含重金属离子的电镀废液不能随意排放
D. 铜的金属活泼性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀
难度: 中等查看答案及解析
-
分子式为C3H7OCl能与金属钠反应放出气体的有机物有几种(不考虑立体异构)
A. 3 B. 5 C. 6 D. 8
难度: 中等查看答案及解析
-
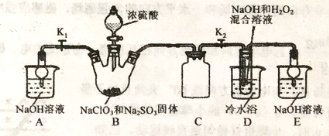
下列选用的仪器和药品能达到实验目的的是
A
B
C
D
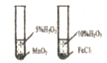


准确量取一定体积KMnO4标准溶液
探究不同催化剂对反应速率的影响
观察Fe(OH)2的颜色
证明非金属性S>Si
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
工业上可由乙苯(C8H10)生产苯乙烯(C8H8),其反应原理是:
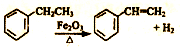 下列说法中错误的是
下列说法中错误的是A. 可用溴的四氯化碳来鉴别乙苯和苯乙烯
B. 乙苯分子中所有原子可能都处于同一平面
C. 苯乙烯可发生氧化反应、取代反应、加成反应
D. 乙苯与苯互为同系物
难度: 中等查看答案及解析
-
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
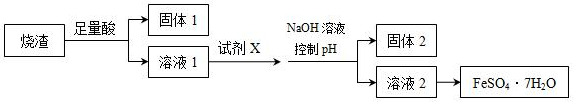
下列说法不正确的是
A. 溶液1中的阳离子可与NH4+、HCO3-、I-、SO42-在同一溶液中大量共存
B. 向溶液2中加入3-5滴K3[Fe(CN)6](铁氰化钾)溶液,可观察到有蓝色沉淀生成
C. 向固体2中加入足量NaOH溶液,发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O
D. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
难度: 中等查看答案及解析
-
已知镓(31Ga)和溴(35Br)是第四周期的主族元素。下列分析正确的是
A. 原子半径:Br>Ga>Cl>Al
B. 碱性:Ga(OH)3>Al(OH)3 酸性:HClO4>HBrO4
C. 7935Br与8135Br得电子能力不同
D. 与镓同周期且相邻的主族元素,其原子序数为30或32
难度: 简单查看答案及解析
-
常温下,下列有关电解质溶液的说法正确的是
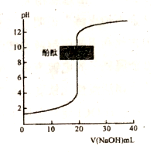
A. 含有AgBr和AgI固体的悬浊液:c(Ag+)>c(Br-)=c(I-)
B. 25℃时,0.1mol·L-1醋酸溶液PH=a,0.01mol·L-1醋酸溶液PH=b,则b=a+1
C. 常温下,右图表示以酚酞作指示剂,用0.1mol·L-1NaOH溶液滴定未知浓度的盐酸,滴定至终点时,溶液一定呈中性
D. 向0.1mol·L-1的氨水中加入硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)减小
难度: 中等查看答案及解析
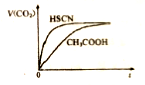
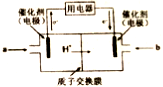
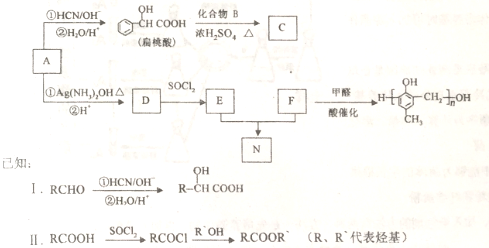
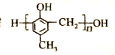 的合成路线如下:
的合成路线如下: