-
甲醇又称“木精”,是非常重要的化工原料。
(1)CO和H2在高温、高压、催化剂条件下反应可制备甲醇。根据下表中相关化学键键能(键能是断裂1mol化学键时需要吸收的能量,或形成1mol化学键时释放的能量)数据,写出CO(CO分子中含有C=O)和H2反应生成甲醇的热化学方程式______。
| 化学键 | H-H | O-H | C-H | C-O | C=O |
| 键能/KJ·mol-1 | 436 | 463 | 413 | 351 | 1076 |
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。
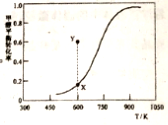
①该脱氢反应的ΔH___0(填“>”、“<”或“=”)
②600K时,Y点甲醇的V(正)___V(逆)(填“>”、“<”或“=”),判断依据是_____
③下列叙述不能说明该脱氢反应已经达到平衡状态的是_____。
A.c(CH3OH)=c(HCHO) B.HCHO的体积分数保持不变
C.V正(CH3OH)=V逆(HCHO) D.混合气体平均分子量保持不变
(3)一定条件下,甲醇与一氧化碳反应可以合成乙酸。已知:常温下,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5;Ka(HSCN)=0.13。
常温下,将20mL0.10mol·L-1CH3COOH溶液和20mL0.10mol·L-1HSCN溶液分别与20mL0.10mol·L-1NaHCO3溶液混合,实验测得产生CO2气体体积V随时间t变化的示意图如下图所示:
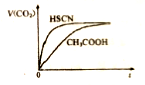
①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是_______,反应结束后所得两溶液中,C(CH3COO-)____ c(SCN-)(填“>”、“<”或“=”)。
②常温条件下,将amol·L-1的CH3COOH与bmol·L-1Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为_______。
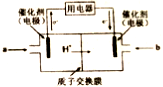
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图所示,则通入a气体电极的电极反应式为___________。
-
甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”。甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域。已知甲醇制备的有关化学反应如下:
反应①:CO(g)+2H2(g)  CH3OH(g) △H1=-90.77kJ/mol
CH3OH(g) △H1=-90.77kJ/mol
反应②:CO2(g)+H2(g)  CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应③:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
(1)反应②的△H2=__________________
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正________V逆(填“>”、“=”或“<”)
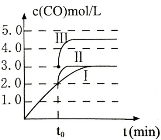
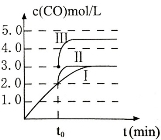
(3)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。当曲线I变为曲线II时,改变的条件是 。当通过改变压强使曲线I变为曲线III时,曲线III达到平衡时容器的体积为_____________。
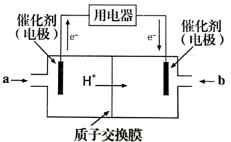
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图所示,则通入a气体的电极电极反应式为 。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为________________。
-
甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”。甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域。已知甲醇制备的有关化学反应如下:反应①:CO(g)+2H2(g)  CH3OH(g) △H1=-90.77kJ/mol 反应②:CO2(g)+H2(g)
CH3OH(g) △H1=-90.77kJ/mol 反应②:CO2(g)+H2(g)  CO(g)+H2O(g) △H2 反应③:CO2(g)+3H2(g)
CO(g)+H2O(g) △H2 反应③:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
(1)反应②的△H2=__________________
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,则K3=_________(用K1、K2表示)。已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正________V逆(填“>”、“=”或“<”)
(3)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。当曲线I变为曲线II时,改变的条件是 。当通过改变压强使曲线I变为曲线III时,曲线III达到平衡时容器的体积为_____________。
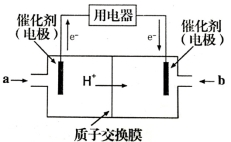
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图所示,则通入a气体的电极电极反应式为
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为________________
-
甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”。甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域。
已知甲醇制备的有关化学反应如下
反应①:CO(g)+2H2(g)=CH3OH(g) △H1=﹣90.77kJ•mol-1
反应②:CO2(g)+H2(g)=CO(g)+H2O(g) △H2
反应③:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3=﹣49.58kJ•mol-1
(1)反应②的△H2=_________ kJ•mol-1。 。
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,则K3=______(用K1、K2表示)。已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时 V正________V逆(填“>”、“=”或“<”=。
(3)在3L密闭容器中发生反应②,c(CO)随反应时间t变化如图1中曲线Ⅰ所示。若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是________________。
当通过改变压强使曲线Ⅰ变为曲线Ⅲ时,曲线Ⅲ达到平衡时容器的体积为______________。
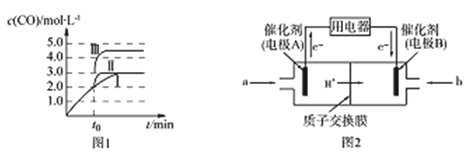
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图2所示,则电极A的电极反应式为_________________________。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与bmol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示醋酸的电离常数为____________________。
-
(16分)甲醇又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g) CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g) CO2(g)+2H2(g) △H=Q2kJ·mol-1
CO2(g)+2H2(g) △H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为 。
(2)工业上可用CO和H2O (g) 来合成CO2 和H2,再利用(1)中反应原理合成甲醇。某温度下,将1molCO和1.5molH2O充入10L固定密闭容器中进行化学反应:CO(g)+H2O(g) CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
①0~10min内H2O(g)的平均反应速率为 。
②若想加快正反应速率的同时提高CO的转化率,可以采用的方法是 。
a.升高温度 b.缩小容器的体积
c.增大H2O (g)的浓度 d.加入适当的催化剂
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),重新达到化学平衡状态时,此时平衡混合气体中H2的体积分数为 。
(3)甲醇燃料电池是符合绿色化学理念的新型燃料电池,下图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为0.1 mol/L CuSO4溶液 (假设反应前后溶液体积不变),当向甲池通入气体a和b时,D极附近呈红色。回答下列问题:

① a物质是 ,A电极的电极反应式为 。
② 乙装置中的总化学反应方程式为 。
③ 当乙装置中C电极收集到224mL(标况下)气体时, 丙中溶液的pH= 。
-
甲醇又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g) CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g) CO2(g)+2H2(g) △H=Q2kJ·mol-1
CO2(g)+2H2(g) △H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为____。
(2)工业上可用CO和H2O (g) 来合成CO2和H2,再利用(1)中反应原理合成甲醇。某温度下,将1molCO和1.5molH2O充入10L固定密闭容器中进行化学反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
①0~10min内H2O(g)的平均反应速率为_________________。
②若想加快正反应速率的同时提高CO的转化率,可以采用的方法是__________。
a.升高温度 b.缩小容器的体积
c.增大H2O (g)的浓度 d.加入适当的催化剂
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),重新达到化学平衡状态时,此时平衡混合气体中H2的体积分数为_____。
(3)甲醇燃料电池是符合绿色化学理念的新型燃料电池,下图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为0.1 mol/L CuSO4溶液 (假设反应前后溶液体积不变) ,当向甲池通入气体a和b时,D极附近呈红色。回答下列问题:

①a物质是__________, A电极的电极反应式为__________。
②乙装置中的总化学反应方程式为___________________。
③当乙装置中C电极收集到224mL(标况下)气体时, 丙中溶液的pH=____。
-
(15分)甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上通常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:
2H2(g)+CO(g) CH3OH(g) ΔH=-90.8kJ/mol。
CH3OH(g) ΔH=-90.8kJ/mol。
(1)该反应的平衡常数表达式为:K= ,如升高温度,K值将 (填:增大、减小或不变)。
(2)以下各项不能说明该反应达到平衡状态的是 .
A、混合气体的密度保持不变 B、甲醇的质量分数保持不变
C、CO的浓度保持不变 D、2v逆(H2)=v正(CH3OH)
(3)在2100C、2400C和2700C三种不同温度、2 L恒容密闭容器中研究合成甲醇的规律。
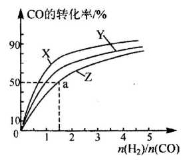
上图是上述三种温度下不同的H2和C0的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是 。由起始达到a点所需时间为5min,则H2的反应速率 mol/(L·min)。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。
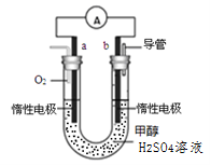
①该电池工作时,正极是 极(填“a”或 “b”);
②该电池负极反应的离子方程式为 。
-
H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
Ⅰ.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为_____________。
Ⅱ.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为________。
(3)已知:25 ℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g)  H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
(4)已知:断裂1 mol分子中的化学键所需吸收的能量如表所示。
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
| 能量/(kJ·mol-1) | 1 319 | 442 | x | 678 | 930 | 1 606 |
表中x=________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
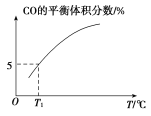
①随着温度升高,CO的平衡体积分数_____(填“增大”或“减小”)。原因为_______
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_____;反应ⅰ的平衡常数为_____(保留两位有效数字)。
-
H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
Ⅰ.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为_____________。
Ⅱ.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为________。
(3)已知:25 ℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g)  H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
(4)已知:断裂1 mol分子中的化学键所需吸收的能量如表所示。
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
| 能量/(kJ·mol-1) | 1 319 | 442 | x | 678 | 930 | 1 606 |
表中x=________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
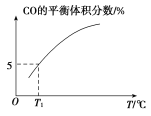
①随着温度升高,CO的平衡体积分数_____(填“增大”或“减小”)。原因为_______
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_____;反应ⅰ的平衡常数为_____(保留两位有效数字)。
-
H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
I.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为________________________。
II.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为____________。
(3)己知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27,该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通人H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=_________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g) H2S(g)+CO(g) △H=+7 kJ·mol-1;
H2S(g)+CO(g) △H=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
(4)己知:断裂1 mol分子中的化学键所需吸收的能量如下表所示。
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
| 能量/ kJ·mol-1 | 1319 | 442 | x | 678 | -930 | 1606 |
表中x=___________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
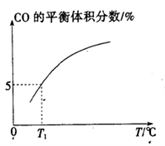
①随着温度升高,CO的平衡体积分数____________(填“增大”或“减小”),原因为_______________。
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_________;反应i的平衡常数为____________(保留两位有效数字)。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。














