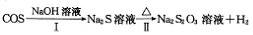-
H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
I.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为________________________。
II.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为____________。
(3)己知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27,该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通人H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=_________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g) H2S(g)+CO(g) △H=+7 kJ·mol-1;
H2S(g)+CO(g) △H=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
(4)己知:断裂1 mol分子中的化学键所需吸收的能量如下表所示。
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
| 能量/ kJ·mol-1 | 1319 | 442 | x | 678 | -930 | 1606 |
表中x=___________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
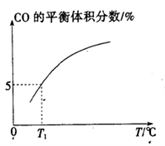
①随着温度升高,CO的平衡体积分数____________(填“增大”或“减小”),原因为_______________。
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_________;反应i的平衡常数为____________(保留两位有效数字)。
-
H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
Ⅰ.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为_____________。
Ⅱ.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为________。
(3)已知:25 ℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g)  H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
(4)已知:断裂1 mol分子中的化学键所需吸收的能量如表所示。
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
| 能量/(kJ·mol-1) | 1 319 | 442 | x | 678 | 930 | 1 606 |
表中x=________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
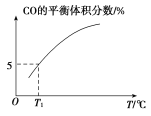
①随着温度升高,CO的平衡体积分数_____(填“增大”或“减小”)。原因为_______
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_____;反应ⅰ的平衡常数为_____(保留两位有效数字)。
-
H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
Ⅰ.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为_____________。
Ⅱ.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为________。
(3)已知:25 ℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g)  H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
(4)已知:断裂1 mol分子中的化学键所需吸收的能量如表所示。
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
| 能量/(kJ·mol-1) | 1 319 | 442 | x | 678 | 930 | 1 606 |
表中x=________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
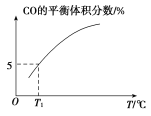
①随着温度升高,CO的平衡体积分数_____(填“增大”或“减小”)。原因为_______
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_____;反应ⅰ的平衡常数为_____(保留两位有效数字)。
-
H2S 在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
(一)H2S 是煤化工原料气脱硫过程的重要中间体。反应原理为
①COS(g)+H2(g) H2S(g)+CO(g) △H=+7kJ/mol
H2S(g)+CO(g) △H=+7kJ/mol
②CO(g)+H2O(g) CO2(g)+H2(g) △H=-42kJ/mol
CO2(g)+H2(g) △H=-42kJ/mol
已知断裂 1mol 气态分子中的化学键所需能量如下表所示。
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
| 能量/kJ/mol | 1310 | 442 | x | 678 | 930 | 1606 |
(1)计算表中 x=____________。
(2)向VL容积不变的密闭容器中充入1molCOS(g)、amolH2(g)和1molH2O(g),发生上述两个反应,其他条件不变时,容器内CO的平衡体积分数与温度(T)的关系如下图所示。
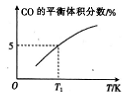
已知:TIK时测得平衡体系中COS为0.80mol,H2为0.85mol。
① 随着温度的升高,CO的平衡体积分数增大,理由是____________。
② a=______。T1K时CO的平衡转化率为_______
③ T1K 时容器内总压强为pMPa,用气体分压代替气体浓度计算反应l 压强平衡常数Kp=____气体组分的分压=总压强×(气体组分的物质的量/气体总物质的量)(结果保留2位小数)。
(3)少量的羰基硫(COS)用氢氧化钠溶液处理的过程如下(部分产物已略去):
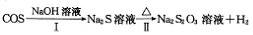
下图是反应Ⅱ中,在不同温度下,反应时间与H2产量的关系图(Na2S的初始含量为3mol),
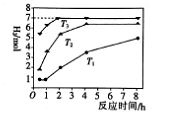
① Na2S溶液显_______(“酸性”或“碱性”)。
② 判断Tl、T2、T3的大小:_______。
(二)H2S 用于金属离子的鉴定。
(4)已知:25℃时,K(sp)(SnS)= 1.0×10-25, K(sp)(CdS)= 8.0×10-27。该温度下,向浓度均为0.1mol/L的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=______(溶液体积变化忽略不计)。
-
运用所学知识回答下列问题。
(1)工业上制备H2S的一种方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。该反应的化学方程式为:__。
(2)煤化工原料气脱硫过程的反应原理为
i.COS(g)+H2(g) H2S(g)+CO(g) △H=+7kJ•mol-1;
H2S(g)+CO(g) △H=+7kJ•mol-1;
ii.CO(g)+H2O(g) CO2(g)+H2(g) △H=-42kJ•mol-1;
CO2(g)+H2(g) △H=-42kJ•mol-1;
①则COS(g)+H2O(g) H2S(g)+CO2(g)△H=___kJ•mol-1;
H2S(g)+CO2(g)△H=___kJ•mol-1;
②向10L容积不变的密闭容器中充入1molCOS(g)、1molH2(g)和1molH2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。随着温度升高,CO的平衡体积分数增大的原因是__。
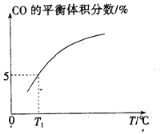
T1℃时,测得平衡时体系中COS的物质的量为0.80mol。则该温度下,COS的平衡转化率为___;反应i的平衡常数为__(小数点后保留两位)。
-
(2018·安徽省合肥市高三第三次教学质量检测)H2S在重金属离子处理、煤化工等领域都有重要应用。请回答:
Ⅰ.H2S是煤化工原料气脱硫过程的重要中间体,反应原理为
ⅰ.COS(g)+H2(g) H2S(g)+CO(g) △H= +7 kJ·mol−1
H2S(g)+CO(g) △H= +7 kJ·mol−1
ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) △H=−42kJ·mol−1
CO2(g)+H2(g) △H=−42kJ·mol−1
已知断裂1mol气态分子中的化学键所需能量如下表所示。
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) |
| 能量(kJ·mol−1) | 1310 | 442 | x | 669 |
(1)计算表中x=_______。
(2)T℃时,向VL容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),发生上述两个反应。
①在T℃时测得平衡体系中COS为0.80 mol,H2为0.85 mol,则T℃时反应ⅰ的平衡常数K=_______(保留2位有效数字)。
②上述反应达平衡后,若向其中再充入1mol COS(g)、1mol H2(g)和1mol H2O(g),则再次达平衡后H2的体积分数_______(填“增大”、“减小”或“不变”);若升高温度,则CO的平衡体积分数_______(填“增大”、“减小”或“不变”),其理由是_______。
Ⅱ.H2S在高温下分解制取H2,同时生成硫蒸气。
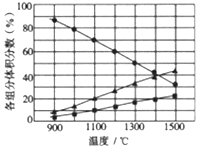
(3)向2L密闭容器中加入0.2molH2S,反应在不同温度(900~1500℃)下达到平衡时,混合气体中各组分的体积分数如下图所示,则在此温度区间内,H2S 分解反应的主要化学方程式为_______;在1300℃时,反应经2min达到平衡,则0~2min的反应速率v(H2S)=_______。
Ⅲ.H2S用作重金属离子的沉淀剂。
(4)25℃时,向浓度均为0.001mol·L−1Sn2+和Ag+的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Ag+)=_______。 (已知:25 ℃时,Ksp(SnS)= 1.0×10−25,Ksp(Ag2S)=1.6×10−49)。
-
铜单质及其化合物在很多领域有重要的用途.
I.如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和 都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
(1)超细铜粉的某制备方法如图所示, 中所含的化学键有 ______ .
中所含的化学键有 ______ .

(2)氯化亚铜 的制备过程是:向
的制备过程是:向 溶液中通入一定量
溶液中通入一定量 ,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 ______ .
,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 ______ .
II.波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.已知 的部分结构可表示如下:
的部分结构可表示如下:

(1)写出铜原子价电子层的电子排布式 ______ ,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有 ______  填元素符号
填元素符号 .
.
(2)请在上图中把 结构中的化学键表示出来._____________
结构中的化学键表示出来._____________
(3) 晶体中配位体是 ______ ,杂化轨道类型是
晶体中配位体是 ______ ,杂化轨道类型是 杂化的原子是 ______ .
杂化的原子是 ______ .
(4)金属晶体Cu中原子的堆积方式如下图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如下图丙所示.
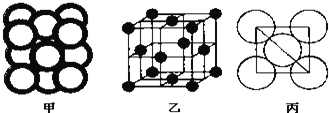
已知 代表阿伏加德罗常数,Cu的相对原子质量为M,Cu单质晶体的密度为d
代表阿伏加德罗常数,Cu的相对原子质量为M,Cu单质晶体的密度为d  该晶体的空间利用率是 ______ ,Cu原子半径的表达式为 ______
该晶体的空间利用率是 ______ ,Cu原子半径的表达式为 ______  用含
用含  、M、d的代数式表示
、M、d的代数式表示
-
乙烷是一种重要的化工原料,可用作制冷剂、燃料、制备乙烯的原料。
请回答下列问题:
I.乙烷蒸汽裂解技术是工业上应用成熟的乙烯制备方法:C2H6(g) C2H4(g)+H2(g) △H。
C2H4(g)+H2(g) △H。
(1)已知:C2H6(g)、H2(g)和CH2CH2(g)的标准燃烧热分别是1560kJ·mol-1、285.8kJ·mol-1和1411.0kJ·mol-1,则△H=___。
(2)1000℃时,在某刚性密闭容器内充入一定量的C2H6(g),只发生反应C2H6(g) CH2=CH2(g)+H2(g)△H,若平衡时容器中总压为pPa,乙烷的转化率为α,则该反应的平衡常数KP=__Pa(用含p、α的代数式表示,KP为用分压表示的平衡常数)。已知1000℃时该反应的KP=4×104Pa,若p=2.1×105,则α=__。达到平衡后,欲同时增大反应速率和α,可采取的措施有__(填选项字母)。
CH2=CH2(g)+H2(g)△H,若平衡时容器中总压为pPa,乙烷的转化率为α,则该反应的平衡常数KP=__Pa(用含p、α的代数式表示,KP为用分压表示的平衡常数)。已知1000℃时该反应的KP=4×104Pa,若p=2.1×105,则α=__。达到平衡后,欲同时增大反应速率和α,可采取的措施有__(填选项字母)。
A.升高温度 B.通入惰性气体
C.增加乙烷浓度 D.加入催化剂
II.乙烷催化氧化裂解法是一种新型的制备乙烯的方法:C2H6(g)+ O2(g)
O2(g) C2H4(g)+H2O(g)△H=-149kJ·mol-1。
C2H4(g)+H2O(g)△H=-149kJ·mol-1。
(3)在乙烷氧化过程中,若 过高,则会导致乙烷转化率降低,且易形成积碳。800℃时,当n(C2H6)和n(O2)的混合气以一定流速通过反应器时,混合气中
过高,则会导致乙烷转化率降低,且易形成积碳。800℃时,当n(C2H6)和n(O2)的混合气以一定流速通过反应器时,混合气中 的比值对乙烷氧化裂解制乙烯的反应性能的影响如图1所示:
的比值对乙烷氧化裂解制乙烯的反应性能的影响如图1所示:
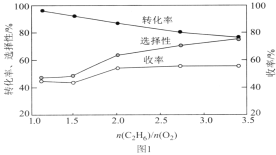
①n 的最佳比值应为__。
的最佳比值应为__。
② 较低时,生成乙烯的选择性较低的原因可能为__。
较低时,生成乙烯的选择性较低的原因可能为__。
Ⅲ.我国科学家利用固体氧化物电解池成功实现了乙烷电化学脱氢制备乙烯,装置如图2所示:
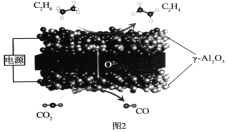
(4)通入CO2的电极为___极(填“阳”或“阴”);C2H6生成C2H4的电极反应式为__。
-
(15分)
氮化硅(Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途.
I.工业上有多种方法来制备氮化硅,常见的方法有:
方法一 直接氮化法:在1300℃-1400℃时,高纯粉状硅与纯氮气化合,其反应方程式为________.
方法二 化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HCl,与方法一相比,用此法制得的氮化硅纯度较高,其原因是________.
方法三 Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和一种气体(填分子式)________;然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为________.
II.工业上制取高纯硅和四氯化硅的生产流程如下:
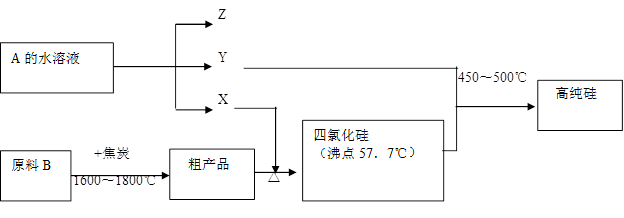
已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色.
(1)写出焦炭与原料B中的主要成分反应的化学方程式:________.
(2)上述生产流程中电解A的水溶液的化学方程式:________.
-
铜单质及其化合物在很多领域有重要的用途.
 一
一 如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和
如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和 都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
(1)超细铜粉的某制备方法如下:

 中所含的化学键有 ______ .
中所含的化学键有 ______ .
(2)氯化亚铜 的制备过程是:向
的制备过程是:向 溶液中通入一定量
溶液中通入一定量 ,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 ______ .
,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 ______ .
 二
二 波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.已知
波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.已知 的部分结构可表示如下:
的部分结构可表示如下:

(1)写出铜原子价电子层的电子排布式 ______ ,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有 ______  填元素符号
填元素符号 .
.
(2)请在上图中把 结构中的化学键用短线“--”表示出来.______
结构中的化学键用短线“--”表示出来.______
(3)往浓 溶液中加入过量较浓的
溶液中加入过量较浓的 直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的
直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的 并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色
并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色 晶体.实验中所加
晶体.实验中所加 的作用是 ______ .
的作用是 ______ .
(4) 晶体中呈正四面体的原子团是 ______ ,杂化轨道类型是
晶体中呈正四面体的原子团是 ______ ,杂化轨道类型是 杂化的原子是 ______ .
杂化的原子是 ______ .
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。