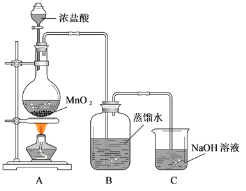
-
海带中含碘元素,有人设计如下步骤来提取碘:①通足量氯气②将海带烧成灰,向灰中加水搅拌 ③加入CCl4振荡 ④过滤 ⑤用分液漏斗分液。合理的操作顺序为
A.②一④一①一③一⑤ B.②一①一③一④一⑤
C.①一③一⑤一②一④ D.③一①一②一⑤一④
难度: 简单查看答案及解析
-
下列物质可以实施人工降雨的是( )
A.AgF B.AgCl C.AgBr D.AgI
难度: 简单查看答案及解析
-
下列各组中两种微粒所含电子数不相等的是( )
A.H3O+和 OH- B.CO 和 N2 C.HNO2 和 NO2- D.CH3+和 NH4+
难度: 简单查看答案及解析
-
分类是化学研究的重要方法,下列物质分类错误的是( )
A.化合物:干冰、明矾、石碱 B.同素异形体:石墨、C60、金刚石
C.非电解质:乙醇、四氯化碳、氯气 D.混合物:漂白粉、纯净矿泉水、碱石灰
难度: 中等查看答案及解析
-
氢元素与其他元素形成二元化合物称为氢化物,有关氢化物的叙述正确的是( )
A.HF 的电子式
B.H2S 的空间构型为直线型
C.NH3 的结构式
D.CH4 是含非极性键的非极性分子
难度: 中等查看答案及解析
-
在“ HI(s)→HI(g)→H2和I2”的变化过程中,被破坏的作用力依次是( )
A.范德华力、范德华力 B.范德华力、共价键
C.共价键、离子键 D.共价键、共价键
难度: 简单查看答案及解析
-
能够产生如图实验现象的液体是( )
A.CS2 B.CCl4 C.H2O D.苯
难度: 简单查看答案及解析
-
用漂粉精漂白时,对提高漂粉精漂白作用无明显效果的是( )
A.食盐 B.CO2 和水蒸气 C.NaHSO4 固体 D.食醋
难度: 简单查看答案及解析
-
将氯气持续通入紫色石蕊试液中,溶液颜色呈现如下变化:

关于溶液中导致变色的微粒Ⅰ、Ⅱ、Ⅲ的判断正确的是( )
A.H+、ClO-、Cl2 B.H+、ClO-、Cl- C.HCl、ClO-、Cl- D.H+、HClO、Cl2
难度: 中等查看答案及解析
-
下列有关 HCl 和 HBr 的叙述错误的是( )
A.键能:HCl>HBr B.热稳定性:HBr>HCl
C.沸点:HBr>HCl D.共用电子对偏移程度:HCl>HBr
难度: 中等查看答案及解析
-
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O-Q
难度: 简单查看答案及解析
-
LED(Light Emitting Diode)即发光二极管,是一种能够将电能转化为光能的固态半导体器件。如图是某课外活动小组设计的用化学电源使 LED 灯发光的装置。下列说法不正确的是( )
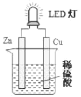
A.装置中存在“化学能→电能→光能”的转化
B.溶液中 SO42-向负极移动
C.铜为阳极,锌为阴极
D.如果将锌片换成铁片,则电路中的电流方向不变
难度: 中等查看答案及解析
-
铋(Bi)元素价态为+3 时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应现象如表所示:
加入溶液
①适量铋酸钠溶液
②过量的双氧水
③适量 KI-淀粉溶液
实验现象
溶液呈紫红色
紫红色消失,产生气泡
溶液变为蓝色
关于 BaBiO3、KMnO4、I2、H2O2 的氧化性由强到弱的顺序为( )
A.I2、H2O2、KMnO4、NaBiO3 B.H2O2、I2、NaBiO3、KMnO4
C.NaBiO3、KMnO4、H2O2、I2 D.KMnO4、NaBiO3、I2、H2O2
难度: 中等查看答案及解析
-
化学家认为氢气与氮气在固体催化剂表面合成氨的反应过程可用如下示意图表示,其中过程⑤表示生成的NH3离开催化剂表面。下列分析正确的是( )
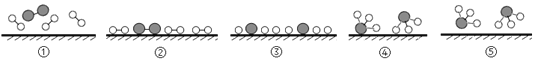
A.催化剂改变了该反应的反应热 B.过程③为放热过程
C.过程②是氢气与氮气分子被催化剂吸附 D.过程④为吸热反应
难度: 中等查看答案及解析
-
羰基硫(COS)是一种有臭鸡蛋气味的无色气体,分子结构与 CO2 相似,高温下分解为 CO 和 S。下列有关说法正确的是( )
A.COS、CO、CO2、S 四种物质的晶体类型相同
B.COS 高温分解时,碳元素化合价升高
C.COS 分子是非极性分子
D.22.4L COS 中约含有 3 6.02 1023 个原子
难度: 中等查看答案及解析
-
如图分别表示红磷、白磷燃烧时的能量变化,有关说法正确的是( )
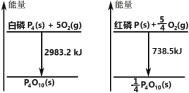
A.白磷比红磷稳定
B.白磷燃烧产物比红磷燃烧产物稳定
C.1mol 白磷转变为红磷放出 2244.7kJ 的热量
D.红磷燃烧的热化学方程式:4P(s)+5O2(g)→P4O10(s)+2954kJ
难度: 中等查看答案及解析
-
在5NH4NO3═ 2HNO3+4N2↑+9H2O中,发生氧化反应的氮原子和发生还原反应的氮原子的质量比是
A.1:1 B.3:5 C.5:3 D.2:8
难度: 简单查看答案及解析
-
配制一定物质的量浓度的 NaOH 溶液时,造成实验结果偏高的是( )
A.转移溶液时有溶液洒落在外 B.定容时观察液面俯视
C.转移溶液后烧杯未洗涤 D.容量瓶中原来有少量蒸馏水
难度: 中等查看答案及解析
-
3.6g碳在一定量的氧气中燃烧,反应后生成的气体质量为9.2g,则在标准状况下,生成物CO和CO2的体积比为( )
A.3:2 B.4:1 C.5:1 D.7:4
难度: 中等查看答案及解析
-
现有 KCl、KBr 的混合物 3.87g,将混合物全部溶解于水,并加入过量的 AgNO3 溶液,充分反应后产生 6.63g 沉淀物,则原混合物中钾元素的质量分数为( )
A.0.241 B.0.259 C.0.403 D.0.487
难度: 中等查看答案及解析