-
化学与生活密切相关。下列说法正确的是
A.通过油脂的在酸性条件的水解反应可以制备肥皂
B.所有的糖类在人体内都可水解且为人体提供能量
C.酯类物质可用作化妆品中的香料也可作胶水溶剂
D.乙烯可以使水果催熟,此过程仅发生了物理变化
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列说法正确的是
A.含有25.2g HNO3的浓硝酸与足量的铜反应产生的NO2分子数目为0.1NA
B.1L0.6mol/L的Na2CO3溶液中含有的O原子数目为1.8NA
C.标准状况下,22.4L的CH3COOH中含有的H原子个数为4NA
D.反应4NH3+6NO
5N2+6H2O中,当生成140g的N2时转移12NA
难度: 中等查看答案及解析
-
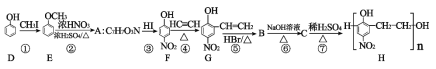
下列关于有机化合物的说法正确的是
A.乙烯可因加成反应而使酸性KMnO4溶液褪色
B.新戊烷又称为2,2-二甲基丙烷
C.C5H12O可以和金属钠反应产生氢气的同分异构体有9种
D.苯的硝化、溴代和氢化反应都是取代反应
难度: 中等查看答案及解析
-
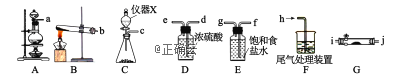
下列有关化学实验的说法正确的是
A.乙醇和乙酸乙酯的混合物可以通过蒸馏装置加以分离
B.为配制Fe(NO3)2溶液需加少许稀HNO3抑制Fe2+水解
C.可用浓溴水彻底吸收浓H2SO4和蔗糖反应产生的气体
D.由于NH3显碱性故可以做成喷泉实验
难度: 中等查看答案及解析
-
用乙醇燃料电池作为电源电解KI溶液的装置如下图所示,下列说法正确的是( )
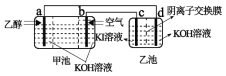
A.甲池中OH-流向b极,乙池中OH-流向c极
B.a极的电极反应方程为:CH3CH2OH-12e-+3H2O=2CO2+12H+
C.已知I2会与OH-产生IO-,则在乙池的右侧会存在IO-
D.当乙池产生2mol气体时,则线路中转移2mole-
难度: 中等查看答案及解析
-
常温下,下列关于电解质溶液中的比值问题说法正确的是
A.pH=11的NaOH和pH=3CH3COOH等体积混合:
<1
B.向Ba(OH)2和氨水的混合液中加入盐酸:
增大
C.向CaCO3和CaSO4的悬浊液中加入少量Na2CO3固体:
增大
D.向CH3COONa溶液中加水稀释:
减小
难度: 困难查看答案及解析