-
下列各项中,能得到氢氧化铝的是
A.氧化铝加到热水中 B.NaAlO2溶液中加入足量CO2
C.铝投入氨水中 D.NaOH溶液中滴入少量AlCl3溶液
难度: 中等查看答案及解析
-
化学与生活密切相关。下列应用中利用了物质氧化性的是( )
A. 明矾净化水 B. 纯碱去油污
C. 食醋除水垢 D. 漂白粉漂白织物
难度: 中等查看答案及解析
-
某500mL溶液中含0.1mol Fe2+,0.2mol Fe3+,加入0.2mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)
A. 0.4mol/L B. 0.6mol/L C. 0.8 mol/L D. 1.0 mol/L
难度: 简单查看答案及解析
-
在元素周期表中,金属元素和非金属元素分界线附近能找到( )
A.制半导体元素 B.制农药元素
C.制催化剂元素 D.制耐高温合金的元素
难度: 简单查看答案及解析
-
某元素的离子带2个单位正电荷,它的核外电子排布为
,此元素在周期表中的
位置是:
A.第二周期零族
B.第三周期ⅡA族
C.第二周期ⅥA族
D.第三周期IIIA
难度: 简单查看答案及解析
-
下列有关金属的描述正确的是
A.金属都是银白色、都有金属光泽,能导电、导热,有延展性
B.金属在常温下都是固体
C.短周期中,导电导热性最好的金属是Al
D.在周期表中金属的种类比非金属少
难度: 简单查看答案及解析
-
化学与生产、生活息息相关,下列叙述错误的是
A.铝罐久盛食醋 B.氢氧化铝可作胃酸的中和剂
C.铁表而镀锌可以增强其抗腐蚀性 D.含重金属离子的电镀废液不能随意排放
难度: 中等查看答案及解析
-
上海世博园地区的一座大型钢铁厂搬迁后,附近居民将不再受到该厂产生的棕红色烟的困扰。你估计这一空气污染物是因为含有( )
A.FeO粉尘 B.Fe2O3粉尘 C.Fe粉尘 D.碳粉
难度: 简单查看答案及解析
-
最近科学家冶炼出纯度高达99.9999%的铁。你估计它不会具有的性质是
A.硬度比生铁低 B.与4mol/L的HCl反应时速率比生铁快
C.在冷的浓硫酸中可钝化 D.在潮湿的空气中不易生锈
难度: 简单查看答案及解析
-
等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是( )
A.2 mol·L-1 H2SO4 B.18 mol·L-1 H2SO4 C.6 mol·L-1 KOH D.3 mol·L-1 HNO3
难度: 中等查看答案及解析
-
在前一种溶液中慢慢滴加后一种试剂,能观察到先生成沉淀后变澄清的是( )
①氯化铝溶液中滴加氢氧化钠溶液,②偏铝酸钠溶液中加盐酸,③氢氧化钠溶液中滴加氯化铝溶液,④氯化铝溶液中滴加氨水。
A.①② B.②③④ C.①②④ D.③④
难度: 简单查看答案及解析
-
人体正常的血红蛋白应含Fe2+。若误食外表与食盐相近的亚硝酸盐,则导致血红蛋白中的Fe2+转化成Fe3 +而中毒,服用维生素C可解除亚硝酸盐中毒,下列叙述中正确的是:
A.亚硝酸盐是还原剂
B.维生素C是还原剂
C.维生素C是氧化剂
D.亚硝酸盐被氧化
难度: 中等查看答案及解析
-
将下列四种铁的化合物溶于稀盐酸,滴加硫氰化钾溶液没有颜色变化,再加入氯水即呈红色的是 ( )
A.FeS B.Fe2O3 C.FeCl3 D.Fe2(SO4)3
难度: 简单查看答案及解析
-
向含有1molKAl(SO4)2的溶液中加入Ba(OH)2溶液,使SO42-恰好完全沉淀,此时Al(OH)3的物质的量为( )
A.1mol B.1.33mol C.1.67mol D.0
难度: 简单查看答案及解析
-
下列离子方程式正确的是( )
A.铁与稀硫酸反应:2Fe+6H+→2Fe3++3H2↑
B.Al与稀H2SO4:Al+2H+→Al3++H2↑
C.偏铝酸钠溶液中加过量HCl:AlO2-+4H+=Al3++2H2O
D.氯化铝溶液中加氨水:Al3++3OH-→Al(OH)3↓
难度: 简单查看答案及解析
-
下列事实不能说明非金属性Cl>I的是( )
A.Cl2+2I-→2Cl-+I2 B.酸性:HClO3>HIO3
C.酸性:HClO4>HIO4 D.稳定性:HCl>HI
难度: 简单查看答案及解析
-
某无色溶液能与铝作用放出氢气,则下列离子组合中可能的是
A.H+、Cl-、Cu2+、Ba2+ B.OH-、 NO3- 、Ba2+、Cl-
C.H+、CO32−、Mg2+、Ba2+ D.OH-、NO3- 、CO32−、Mg2+
难度: 中等查看答案及解析
-
将SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色;继续滴人BaC12溶液,产生白色沉淀。在上述一系列变化过程中,最终被还原的是
A.SO2 B.Cl- C.Fe3+ D.NO3-
难度: 中等查看答案及解析
-
用如图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )
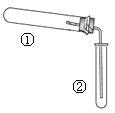
①中实验
②中现象
Ⅰ
铁粉与水蒸气加热
肥皂水冒泡
Ⅱ
加热NH4Cl和Ca(OH)2混合物
酚酞溶液变红
Ⅲ
NaHCO3
澄清石灰水变浑浊
A.只有Ⅰ B.只有Ⅱ
C.只有Ⅲ D.Ⅰ、Ⅱ、Ⅲ均能证实①中反应发生
难度: 简单查看答案及解析
-
某学生做了如下4个实验:
①在铝盐溶液中逐滴加入稀氨水直至过量;
②在明矾溶液中加入氢氧化钡溶液直至过量;
③在含少量氢氧化钠的偏铝酸钠溶液中通入二氧化碳直至过量;
④在少量盐酸的氯化铝溶液中加入氢氧化钠至过量。
在4个图像,纵坐标为沉淀物质的量,横坐标为溶液中加入物质的物质的量,上述实验与图像对应关系正确的是( )


A.①-(d) B.②-(b) C.③-(c) D.④-(a)
难度: 中等查看答案及解析