-
化学与生产、生活密切相关,下列说法正确的是( )
A.明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用
B.淀粉溶液、豆浆、雾、碳素墨水均可发生丁达尔现象
C.合金、光导纤维、碳纤维、玻璃钢都属于复合材料
D.光化学烟雾、臭氧层空洞、温室效应、酸雨(硝酸型)的形成都与氮氧化物有关
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.一定条件下向容积为1L的密闭容器内通入46gNO2,则NO2的物质的量浓度一定为1mol/L
B.标准状况下,22.4L的己烷中有20×6.02×1023个原子
C.1mol氯气溶于水转移6.02×1023个e-
D.0.1molCH5+含6.02×1023个电子
难度: 简单查看答案及解析
-
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) ΔH=xkJ·mol-1
已知碳的燃烧热ΔH1=akJ·mol-1
2K(s)+N2(g)+3O2(g)=2KNO3(s) ΔH2=bkJ·mol-1
S(s)+2K(s)=K2S(s) ΔH3=ckJ·mol-1
则x为( )
A.3a+b-c B.3a-b+c C.a+b-c D.c+a-b
难度: 简单查看答案及解析
-
一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)
CH3OH(g)达到平衡。下列说法正确的是( )

A.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
B.该反应的正反应放热
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的小
难度: 中等查看答案及解析
-
下列研究目的和示意图相符的是( )
选项
A
B
C
D
研究目的
密闭容器中,压强对反应:2SO2(g)+O2(g)
2SO3(g)的影响
固定容积的密闭容器中,温度对反应:N2(g)+3H2(g)
2NH3(g) ΔH<0的影响
等质量Na、K分别与足量水反应
固定容积的密闭容器中,增大CO2浓度,对已达平衡的反应:CO(g)+H2O(g)
CO2(g)+H2(g)的影响
示意图
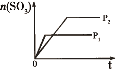



A.A B.B C.C D.D
难度: 简单查看答案及解析
-
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)
COS(g)+H2(g) K=0.1反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A.通入CO后,正反应速率逐渐增大
B.升高温度,H2S浓度增加,表明该反应是吸热反应
C.CO的平衡转化率为80%
D.反应前H2S物质的量为7mol
难度: 简单查看答案及解析
-
室温下,将1.000mol/L盐酸滴入20.00mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )
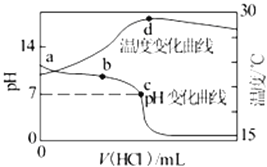
A.a点由水电离出的c(H+)=1.0×10-14mol/L
B.b点时c(NH4+)+c(NH3·H2O)>c(Cl-)
C.c点时消耗的盐酸体积:V(HCl)=20.00mL
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
难度: 简单查看答案及解析
-
向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)
cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示。下列说法正确的是( )

A.该反应在T1、T3温度时达到化学平衡
B.无法判断该反应在T2温度时是否达到化学平衡
C.该反应的逆反应是吸热反应
D.升高温度,平衡会向正反应方向移动
难度: 简单查看答案及解析
-
下列各种情况下能大量共存的离子组为( )
A.pH=7的溶液中:Fe3+、Cl-、Na+、NO3-
B.水电离出的c(H+)=1.0×10-3mol/L的溶液中Na+、CO32-、Cl-、K+
C.pH=1的溶液中NH4+、Cl-、Mg2+、SO42-
D.Al3+、HCO3-、Cl-、K+
难度: 简单查看答案及解析
-
下列有关电解质溶液中粒子浓度关系正确的是( )
A.CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-)
B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-)
C.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)]
难度: 简单查看答案及解析
-
在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )

A.阴、阳两极生成的气体的物质的量之比是1︰2
B.X是电源的负极
C.阴极的反应式是:H2O+2e-=H2+O2- CO2+2e-=CO+O2-
D.总反应可表示为:H2O+CO2
H2+CO+O2
难度: 简单查看答案及解析
-
如图是甲、乙、丙三种不同物质(不含结晶水)的溶解度曲线图。下列有关叙述正确的是( )
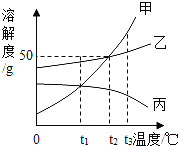
A.t1℃时,分别取出相同质量的甲、乙两种饱和溶液升温到t2℃时,甲和乙溶质的质量分数相等
B.将三种饱和溶液分别从t3℃降低到t2℃时,甲和乙溶质的质量分数减小,丙的溶质的质量分数不变
C.t2℃时,将甲、乙两种饱和溶液分别恒温蒸发等质量的水,析出晶体的质量可能不等
D.当甲的饱和溶液中含有少量乙时,可以采取冷却热饱和溶液的办法提取乙
难度: 简单查看答案及解析
-
下列化学用语的表达正确的是( )
A.原子核内有8个中子的碳原子:
C
B.羟基的电子式:
C.基态Cr的价电子排布式为:3d44s2
D.某元素原子的电子排布图若写为:
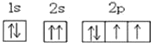 则违背了泡利原理
则违背了泡利原理难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.电子构型为[Ar]3d104s2的元素是过渡金属元素
B.某基态原子3d能级中电子排布的情况可能为

C.在氢原子的电子云图中,每个小黑点代表一个电子
D.当碳原子的核外电子排布由1s22s22p2转变为1s22s12p3时,碳原子由基态变为激发态
难度: 简单查看答案及解析
-
已知1﹣18号元素的离子aAm+、bBn+、cCp-、dDq-都具有相同的电子层结构,下列关系正确的是( )
A.若p>q,则还原性cCp-<dDq-
B.若m>n,则碱性A(OH)m>B(OH)n
C.若半径aAm+>bBn+,则a<b
D.若半径aAm+>bBn+,则A的单质一定能从含Bn+的盐溶液中置换出B
难度: 简单查看答案及解析
-
微粒M和N,肯定属于同族元素且化学性质相似的是( )
A.结构示意图:M为
,N为
B.原子核外电子排布式:M为1s22s2,N为1s2
C.M原子基态2p轨道上有一对成对电子,N原子基态3p轨道上有一对成对电子
D.M原子基态2p轨道上有1个未成对电子,N原子基态3p轨道上有1个未成对电子
难度: 简单查看答案及解析