-
将40mL 1.5mol·L-1的CuSO4溶液与30mL 3mol·L-1的NaOH溶液混合,生成浅蓝色沉淀,假如溶液中c(Cu2+)或c(OH-)都已变得很小,可忽略,则生成沉淀的组成可表示为( )
A.Cu(OH)2 B.CuSO4·Cu(OH)2
C.CuSO4·2Cu(OH)2 D.CuSO4·3Cu(OH)2
难度: 中等查看答案及解析
-
当大量氯气泄漏时,用浸润下列某物质水溶液的毛巾捂住鼻子可防中毒.适宜的物质是
A.NaOH B.KI C.NH3 D.Na2CO3
难度: 简单查看答案及解析
-
铜锌合金俗称黄铜.下列不易鉴别黄铜与真金的方法是( )
A.测密度 B.测熔点 C.灼烧 D.看外观
难度: 简单查看答案及解析
-
将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
A.稀硝酸 B.硝酸铜 C.稀盐酸 D.氢氧化钠
难度: 简单查看答案及解析
-
硝酸铵(NH4NO3)在不同条件下分解可以得到不同的产物,下列各组物质中肯定不可能是硝酸铵分解产物的是
A.N2O、H2O B.N2、O2、H2O C.N2、HNO3、H2O D.NH3、NO、H2
难度: 中等查看答案及解析
-
已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)→2HCl(g)+Q1
H2(g)+Br2(g)→2HBr(g)+Q2
根据上述反应做出的判断正确的是( )
A.Q1>Q2
B.生成物总能量均高于反应物总能量
C.生成1mol HCl(g)放出Q1热量
D.等物质的量时,Br2(g)具有的能量低于Br2(l)
难度: 中等查看答案及解析
-
将足量CO2通入下列各溶液中,所含离子还能大量共存的是( )
A.K+、OH﹣、Cl﹣、SO42﹣
B.H+、NH4+、Al3+、NO3﹣
C.Na+、S2﹣、Cl﹣、SO42﹣
D.Na+、C6H5O﹣、CH3COO﹣、HCO3﹣
难度: 中等查看答案及解析
-
铊(Tl)与铝同族。Ti3+在酸性溶液中就能发生反应:Tl3++2Ag=Tl++2Ag+。下列推断错误的是
A.Tl+的最外层有1个电子
B.Tl能形成+3价和+1价的化合物
C.酸性溶液中Tl3+比Tl+氧化性强
D.Tl+的还原性比Ag弱
难度: 简单查看答案及解析
-
一定条件下,碳钢腐蚀与溶液pH的关系如下表。下列说法错误的是( )
pH
2
4
6
6.5
8
13.5
14
腐蚀快慢
较快
慢
较快
主要产物
Fe2+
Fe3O4
Fe2O3
FeO2﹣
A.当pH<4时,碳钢主要发生析氢腐蚀
B.当pH>6时,碳钢主要发生吸氧腐蚀
C.当pH>14时,正极反应为O2+4H++4e→2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
难度: 中等查看答案及解析
-
X+、Y+、M2+、N2﹣均为含有一定数目电子的短周期元素的简单离子,离子半径大小关系是:N2﹣>Y+、Y+>X+、Y+>M2+,下列比较正确的是( )
A.原子半径:N可能比Y大,也可能比Y小
B.原子序数:N>M>X>Y
C.M2+、N2﹣核外电子数:可能相等,也可能不等
D.碱性:M(OH)2>YOH
难度: 中等查看答案及解析
-
新型材料B4C可用于制作切削工具和高温热交换器。关于B4C的推断正确的是
A. B4C是一种分子晶体 B. B4C是该物质的分子式
C. B4C是一种原子晶体 D. B4C的电子式为
难度: 中等查看答案及解析
-
我国科学家成功地研制出长期依赖进口、价格昂贵的物质
O2.下列说法正确的是( )
A.它是
O2的同分异构体
B.它是O3的一种同素异形体
C.
O2与
O2互为同位素
D.1molO2分子中含有20mol电子
难度: 简单查看答案及解析
-
分别含有下列各物质的废弃试剂,倒在同一废液缸中不会引起实验室污染或危险的一组是( )
A.氨水和NaOH B.硫酸铵和氯化钡
C.硝酸亚铁和盐酸 D.电石和盐酸
难度: 中等查看答案及解析
-
聚乳酸是一种生物降解塑料,结构简式为
.下列说法正确的是( )
A.聚乳酸的相对分子质量是72
B.聚乳酸的分子式是C3H4O2
C.乳酸的分子式是C3H6O2
D.聚乳酸可以通过水解降解
难度: 简单查看答案及解析
-
以石墨为电极分别电解水和饱和食盐水,关于两个电解池反应的说法正确的是( )
A.阳极反应式相同
B.电解结束后所得液体的pH相同
C.阴极反应式相同
D.通过相同电量时生成的气体总体积相等(同温同压)
难度: 中等查看答案及解析
-
给下列物质分别加入溴水中,不能使溴水褪色的是( )
A. Na2SO3晶体 B. C2H5OH C. C6H6 D. Fe
难度: 中等查看答案及解析
-
某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字试验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析不合理的是( )
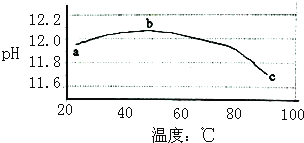
A.碳酸钠水解是吸热反应
B.ab段说明水解平衡向右移动
C.bc段说明水解平衡向左移动
D.水的电离平衡也对pH产生影响
难度: 中等查看答案及解析
-
下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是( )
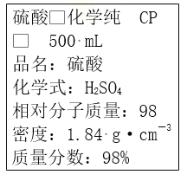
A.该硫酸的物质的量浓度为9.2 mol·L-1
B.1 mol Zn与足量该硫酸反应产生2 g氢气
C.配制200 mL 4.6 mol·L-1的稀硫酸需取该硫酸50 mL
D.该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol·L-1
难度: 中等查看答案及解析
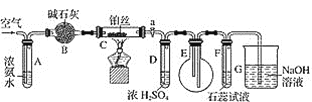
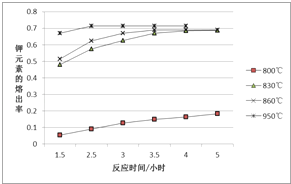
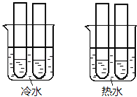


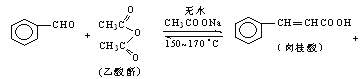 CH3COOH
CH3COOH