-
已知强酸与强碱的稀溶液发生中和反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,向0.1 L 0.2 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀盐酸,恰好完全反应。则其焓变ΔH1、ΔH2、ΔH3的关系是( )
A.ΔH1>ΔH2>ΔH3 B.ΔH1>ΔH3>ΔH2 C.ΔH1=ΔH3>ΔH2 D.ΔH1<ΔH3<ΔH2
难度: 中等查看答案及解析
-
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-Q1
②H2(g)+
O2(g)=H2O(g) ΔH2=-Q2
③H2(g)+
O2(g)=H2O(l) ΔH3=-Q3
常温下取体积比为4:1的甲烷和氢气共11.2L(已折合成标准状况)经完全燃烧恢复到常温,放出的热量为( )
A.0.4Q1+0.05Q2 B.0.4Q1+0.1Q2
C.0.4Q1+0.1Q3 D.0.4Q1+0.05Q3
难度: 中等查看答案及解析
-
50mL0.5mol/L盐酸与50mL0.55mol/LNaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是
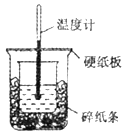
A.从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题
B.大烧杯上如不盖硬纸板,测得的中和热数值会偏大
C.用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会偏大
D.实验中改用60mL0.5mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上实验相比,所放出的热量不相等,但是所求中和热相等
难度: 中等查看答案及解析
-
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂 1mol N﹣N键吸收193kJ热量,断裂 1mol N≡N键吸收941kJ热量,则下列说法不正确的是( )

A.N4与N2互为同素异形体
B.1 mol N4气体转化为N2时要放出724 kJ能量
C.N4变成N2是化学变化
D.N4不可能是分子晶体
难度: 中等查看答案及解析
-
在298K、1.01×105Pa下,将0.5molCO2通入750mL1mol·L-1NaOH溶液中充分反应,测得反应放出xkJ的热量。已知在该条件下,1molCO2通入1L2mol·L-1NaOH溶液中充分反应放出ykJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
A.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2y-x)kJ·mol-1
B.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2x-y)kJ·mol-1
C.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1
D.2CO2(g)+2NaOH(l)=2NaHCO3(l) ΔH=-(8x-2y)kJ·mol-1
难度: 困难查看答案及解析
-
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A.正极反应为AgCl +e-=Ag +Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
难度: 中等查看答案及解析
-
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为2Fe+2H2O+O2=2Fe(OH)2。以下说法正确的是( )
A.钢柱在水下部分比在空气与水交界处更容易腐蚀
B.原电池是将电能转变为化学能的装置
C.正极发生的反应为2H2O+O2+2e-=4OH-
D.负极发生的反应为Fe-2e-=Fe2+
难度: 简单查看答案及解析
-
如图是甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH +3O2
2CO2+ 4H2O。下列说法不正确的是
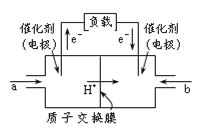
A.左电极为电池的负极,a处通入的物质是甲醇
B.正极反应式为:O2+ 2H2O + 4e-= 4OH-
C.负极反应式为:CH3OH + H2O-6e- = CO2+ 6H+
D.该电池提供1mole-,消耗氧气0.25mol
难度: 中等查看答案及解析
-
直接煤一空气燃料电池原理如图所示,下列说法错误的是( )
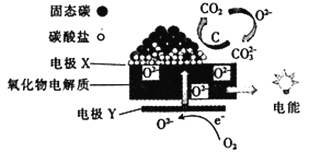
A.随着反应的进行,氧化物电解质的量不断减少
B.负极的电极反应式为C+2CO32--4e-=3CO2↑
C.电极X为负极,O2-向X极迁移
D.直接煤一空气燃料电池的能量效率比煤燃烧发电的能量效率高
难度: 困难查看答案及解析
-
Li-SO2电池具有输出功率高和低温性能好等特点。其电解质是LiBr,溶剂是碳酸丙烯酯和乙腈,电池反应为2Li+2SO2
 Li2S2O4。下列说法正确的是( )
Li2S2O4。下列说法正确的是( )A.该电池反应为可逆反应
B.放电时,Li+向负极移动
C.充电时,阴极反应式为Li++e一=Li
D.该电池的电解质溶液可以换成LiBr的水溶液
难度: 中等查看答案及解析
-
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
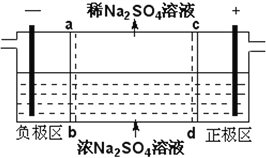
A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
难度: 中等查看答案及解析
-
铝表面在空气中天然形成的氧化膜耐磨性和抗蚀性不够强。控制一定的条件,用如图所示的电化学氧化法,可在铝表面生成坚硬致密,耐腐蚀的氧化膜。下列有关叙述正确的是( )
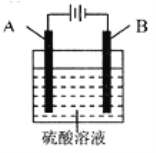
A.阴极上有金属铝生成
B.电极A为石墨,电极B为金属铝
C.OH-在电极A上放电,有氧气生成
D.阳极的电极反应式为:2Al-6e-+3H2O═Al2O3+6H+
难度: 中等查看答案及解析
-
金属镍有广泛的有途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法备高纯度的镍,下列叙述正确的是(已知氧化性:Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,电极反应式:Ni2++2e-=Ni
B.电解后,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中有Cu和Pt
难度: 困难查看答案及解析
-
图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )
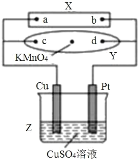
A.滤纸上c点附近会变红色
B.Cu电极质量减小,Pt电极质量增大
C.Z中溶液的pH先减小,后增大
D.溶液中的SO42-向Cu电极定向移动
难度: 困难查看答案及解析
-
用石墨电极电解100mL的氯化钠溶液,当电路中通过1mole-时,阴阳两极产生的气体体积比为5:3,则原氯化钠溶液的物质的量浓度(mol/L)为( )
A.4 B.2 C.1 D.5
难度: 困难查看答案及解析
-
用石墨作电极电解1LAgNO3溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中c(Ag+)为( )
A.2mol/L B.1.5mol/L C.1mol/L D.0.5mol/L
难度: 困难查看答案及解析