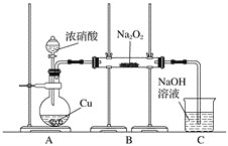
-
在下列试剂中,可以一次性将氢氧化钡、盐酸、碳酸钠三种溶液区别开来的试剂的是
A. 稀硫酸 B. 氯化钡溶液 C. 硝酸银溶液 D. 稀硝酸
难度: 简单查看答案及解析
-
分离下列混合物,按溶解、过滤、蒸发顺序进行的是
A. 碳酸钙、木炭 B. 氧化铜、硝酸钾
C. 乙醇、碘 D. 硝酸钾、氯化钠
难度: 简单查看答案及解析
-
某胶体遇盐卤(MgCl2)或石膏水发生凝聚,而遇食盐水或硫酸钠溶液不易发生凝聚,下列说法中错误的是( )
A. 胶体粒子直径在l~100 nm之间
B. 遇BaCl2溶液或氢氧化铁胶体可发生凝聚
C. 电泳时,该胶体向阴极方向移动
D. 钠离子使此胶体凝聚的效果不如Ca2+、Mg2+
难度: 简单查看答案及解析
-
取氯化钠进行焰色反应实验,火焰呈现黄色,显色的原因是( )
A. 氯化钠受热挥发 B. 氯化钠受热分解
C. 钠离子中电子跃迁 D. 氯离子中电子跃迁
难度: 简单查看答案及解析
-
两份铝屑,第一份与过量的盐酸反应,第二份与过量的氢氧化钠溶液反应,产生氢气的体积比为1∶2,则第一份与第二份铝屑的质量比为( )
A.1∶1 B.1∶2 C.1∶3 D.1∶4
难度: 简单查看答案及解析
-
在无机非金属材料中,硅一直扮演着主要的角色。下列物质中主要成分是Si的是( )
A. 水晶 B. 玛瑙 C. 石英 D. 计算机芯片
难度: 简单查看答案及解析
-
碱石灰干燥剂是由氢氧化钠和氧化钙组成的固体混合物,下列气体可以用碱石灰来干燥的是( )
A.氯化氢 B.氧气 C.二氧化碳 D.二氧化硫
难度: 简单查看答案及解析
-
蛇纹石可以看作由氧化镁、氧化铝、二氧化硅、氧化铁组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入氢氧化钠溶液至过量。下列叙述不正确的是( )
A.沉淀X的成分是二氧化硅
B.将蛇纹石试样直接溶于过量的氢氧化钠溶液后过滤,可得到纯净的红色颜料氧化铁
C.在溶液Y中加入过量的氢氧化钠溶液,过滤得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
D.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
A.Ba2++SO42—=BaSO4↓可表示氯化钡溶液与硫酸钠溶液的反应
B.H++OH-=H2O可表示强碱氢氧化钠、氢氧化钾分别与盐酸、硫酸间的反应
C.CO32—+2H+=CO2↑+H2O表示可溶性碳酸盐与强酸之间的复分解反应
D.BaCO3+2H+=Ba2++CO2↑+H2O表示碳酸钡与强酸之间的复分解反应
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.蔗糖无毒,为了探究它的甜味,可从试剂瓶中取少量进行品尝
B.氯化氢气体极易溶于水,吸收氯化氢尾气时应考虑添加防倒吸装置
C.欲配制少量稀硫酸溶液,可取少量浓硫酸于试管中加水稀释
D.酒精灯不用时可用扇子扇灭,既简便又快捷
难度: 简单查看答案及解析
-
初中化学教材中“家庭小实验”是利用家庭日常生活用品进行化学学习和探究的活动。食盐、食醋、纯碱等均为家庭厨房中常用的物质,利用这些物质你能完成的实验是
①检验自来水中是否含氯离子 ②鉴别食盐和纯碱 ③检验鸡蛋壳能否溶于酸 ④除去热水瓶中的水垢
A.①②③④ B.②③④ C.②④ D.①③
难度: 中等查看答案及解析
-
下列各组选项按照电解质、非电解质、单质、混合物顺序排列的一项是( )
A.氯化氢、三氧化硫、石墨、液氧
B.氯化钠、乙醇、铁、空气
C.蔗糖、硫酸铜、氮气、波尔多液
D.氯化钾、硝酸钠、氯气、石灰水
难度: 简单查看答案及解析
-
下列可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法及现象是( )
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加BaCl2稀溶液有白色沉淀生成
D.溶于水后滴加澄清石灰水有白色沉淀生成
难度: 简单查看答案及解析
-
将二氧化硫通入显红色的酚酞试液中,发现红色消失,主要原因是( )
A.二氧化硫具有漂白性 B.二氧化硫具有还原性
C.二氧化硫具有氧化性 D.二氧化硫溶于水后生成酸
难度: 简单查看答案及解析
-
下列关于蒸馏实验中仪器使用的说法错误的是( )
A. 酒精灯内酒精不超过容积的2/3 B. 蒸馏烧瓶应垫上石棉网加热
C. 蒸发和蒸馏过程中都需用到玻璃棒 D. 接收馏分的仪器名称为锥形瓶
难度: 简单查看答案及解析
-
高温下硫酸亚铁发生如下反应:2FeSO4
Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )
A.BaSO3和BaSO4 B.BaS C.BaSO3 D.BaSO4
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.0.2 mol氧原子中含1.6NA个电子
B.1 mol 氯化镁中含有离子数为NA
C.12.4 g白磷中含有磷原子数为0.1NA
D.28 g一氧化碳气体所含的电子数为20NA
难度: 简单查看答案及解析
-
饱和氯水长期放置后,下列微粒在溶液中不减少的是
A.Cl2 B.HClO C.Cl- D.H2O
难度: 简单查看答案及解析
-
日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
A.铜器出现铜绿[Cu2(OH)2CO3] B.铁制菜刀生锈
C.大理石雕像被酸性较强的雨腐蚀毁坏 D.铝锅表面生成致密的薄膜(Al2O3)
难度: 简单查看答案及解析
-
铝溶于氢氧化钠溶液中,4mol铝失去的电子完全被水获得,则作为氧化剂水的物质的量为( )
A.2mol B.4mol C.6mol D.12mol
难度: 简单查看答案及解析
-
在
被水吸收的反应中,发生还原反应和氧化反应的物质的质量比为( )
A. 3:1 B. 1:3 C. 1:2 D. 2:1
难度: 中等查看答案及解析
-
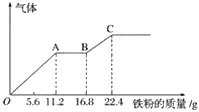
等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应后,都生成+2价的硫酸盐,其产生氢气的体积与反应时间的关系如图所示,则下列说法正确的是
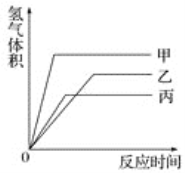
A. 三种金属的活动性顺序为甲>乙>丙
B. 反应结束消耗硫酸的质量一定相同
C. 三种金属的相对原子质量是甲>乙>丙
D. 甲先反应完,乙最后反应完
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.液态氯化氢、固态氯化钠都不导电,所以氯化氢、氯化钠都是非电解质
B.氨气、二氧化碳的水溶液都能导电,所以氨气、二氧化碳都是电解质
C.蔗糖、酒精在水溶液里或熔融状态时都不导电,所以它们是非电解质
D.铜、石墨都导电,所以它们都是电解质
难度: 简单查看答案及解析
-
下列离子方程式中,正确的是( )
A. 小苏打溶液与少量澄清石灰水混合:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. AlCl3溶液中加入足量的氨水:Al3++4OH-===AlO2-+2H2O
C. 将氯气通入水中:Cl2+H2O===Cl-+ClO-+2H+
D. 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
难度: 中等查看答案及解析