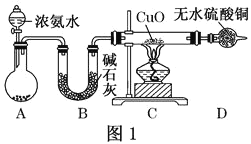
-
化学与生活、科技、医药、工业生产均密切相关,下列有关化学叙述正确的是( )
A. 浓硫酸具有强腐蚀性,可用浓硫酸刻蚀石英制艺术品
B. 我国预计2020年发射首颗火星探测器太阳能电池帆板的材料是二氧化硅
C. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应
D. 误食重金属盐引起的人体中毒,可喝大量的食盐水解毒
难度: 中等查看答案及解析
-
下列推断正确的是
A.SiO2是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C.CO、NO、NO2都是大气污染物气体,在空气中都能温室存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分震荡后溶液显红色
难度: 简单查看答案及解析
-
下列实验过程中对异常情况的原因分析,没有依据的是( )
选项
异常情况
可能的原因
A
蒸发结晶时,蒸发皿破裂
将溶液蒸干,或酒精灯灯芯碰到蒸发皿底部
B
分液时,分液漏斗中的液体很难滴下
没有打开分液漏斗颈上的玻璃塞或塞上的凹槽与漏斗上小孔没有对齐
C
萃取时,振荡溶液,静置不分层
萃取剂加的太多
D
蒸馏时,发现冷凝管破裂
没有通冷凝水或先加热后通冷凝水
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列关于化学试剂的保存方法不正确的是( )
A.NaOH溶液保存在配有玻璃塞的试剂瓶中
B.硝酸见光易分解,故需保存在棕色瓶中
C.FeCl2溶液保存时需加入少量铁粉和盐酸
D.白磷易自燃,可保存在水中
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列说法中正确的是( )
A.1L1mol/LK2SO4溶液中的氧原子数目为4NA
B.常温常压下,32g氧气所含分子的数目为NA
C.标准状况下,22.4LH2O含有氢原子的数目为2NA
D.11.2LH2含有氢原子的数目为NA
难度: 中等查看答案及解析
-
下列反应的离子方程式,正确的是( )
A.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O
B.钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
C.氯气通入水中Cl2+H2O=Cl-+ClO-+2H+
D.FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl-
难度: 中等查看答案及解析
-
下列溶液中的离子一定能大量共存的是( )
A.含大量H+的溶液中:Na+、K+、SO42-、HCO3-
B.在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3-
C.能使酚酞变红的溶液中:Na+、NO3-、K+、AlO2-
D.含大量Fe3+的溶液中:NH4+、Na+、I-、SCN-
难度: 中等查看答案及解析
-
下列推断合理的是( )
A.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可对水进行杀菌、消毒
B.漂白液在空气中久置会变质,应密封并置于阴暗处保存
C.常温下Fe、Al遇浓HNO3发生钝化,故Fe、Al不能与浓HNO3发生反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色
难度: 中等查看答案及解析
-
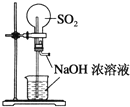
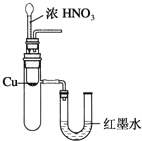
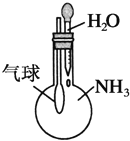
下列实验装置不能达到实验目的的是( )
A.用SO2做喷泉实验
B.验证Cu与浓硝酸反应的热量变化
C.验证NH3易溶于水
D.比较Na2CO3与NaHCO3的稳定性
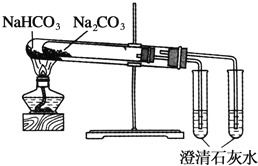
难度: 中等查看答案及解析
-
下列实验过程中,始终无明显现象的是( )
A.NO2通入FeSO4溶液中
B.SO2通入已酸化的Ba(NO3)2溶液中
C.NH3通入AlCl3溶液中
D.CO2通入CaCl2溶液中
难度: 中等查看答案及解析
-
在含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的Na2O固体,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是( )
A.Al3+ B.Na+ C.Fe3+ D.Fe2+
难度: 中等查看答案及解析
-
除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法不正确的是( )
选项
待提纯的物质
选用试剂
操作的方法
A
FeCl2溶液(FeCl3溶液)
铁粉
过滤
B
Al2O3(Fe2O3)
NaOH溶液和CO2
溶解、过滤、洗涤
C
Cl2(HCl)
饱和食盐水
洗气
D
Fe(OH)3胶体(NaCl溶液)
水
渗析
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
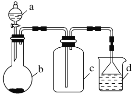
选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
稀硝酸
Cu
NO2
H2O
C
浓硫酸
Na2SO3
SO2
NaOH溶液
D
浓盐酸
MnO2
Cl2
NaOH溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
NH3可消除NO的污染,反应方程式为:6NO+4NH3=5N2+6H2O。现有NO与NH3的混合物共1 mol充分反应,若还原产物比氧化产物多1.4g,则下列判断中正确的是( )
A.原混合物中NO与NH3的物质的量之比可能为3:2
B.有0.6 mol NH3被氧化
C.生成还原产物2.8g
D.原混合气体中含氨气为0.2 mol或0.7 mol
难度: 中等查看答案及解析
-
在某100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4 mol·L-1和0.1 mol·L-1。向该混合溶液中加入1.92 g铜粉,加热,待充分反应后(假设反应前后溶液体积不变),所得溶液中Cu2+的物质的量浓度是( )
A.0.15 mol·L-1 B.0.225 mol·L-1 C.0.35 mol·L-1 D.0.45 mol·L-1
难度: 中等查看答案及解析