-
PH3是一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断错误的是
A.PH3分子呈三角锥形
B.PH3分子是极性分子
C.PH3沸点低于NH3沸点,因为P-H键键能低
D.PH3分子稳定性低于NH3分子,因为N-H键键高
难度: 中等查看答案及解析
-
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为
A. 9.0L B. 13.5L C. 15.7L D. 16.8L
难度: 中等查看答案及解析
-
下列关于化石燃料的加工说法正确的( )
A.石油裂化主要得到乙烯
B.石油分馏是化学变化,可得到汽油、煤油
C.煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气
D.煤制煤气是物理变化,是高效、清洁地利用煤的重要途径
难度: 中等查看答案及解析
-
2012年3月修订的《环境空气质量标准》中新纳入的强制监测指标是
A.PM2.5 B.NOx C.SO2 D.可吸入颗粒物
难度: 简单查看答案及解析
-
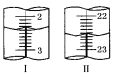
微粒有多种表示方式,下列各组不同表示方式一定代表同种微粒的是
A.C3H6、CH2=CHCH3 B.-OH、
C.
 、
、D.
、1s22s22p63s23p6
难度: 中等查看答案及解析
-
氯化钠是一种重要的生活、生产必需品。下列叙述中正确的是( )
A.锌粒与盐酸反应时,若加入适量氯化钠晶体,可加快反应速率
B.标准状况下,氯化钠溶液呈中性,溶液的pH="7"
C.氯化钠中所含化学键为离子键,含离子键的化合物一定是离子化合物
D.氯化钠溶液导电是化学变化,而熔融态氯化钠导电是物理变化
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.用乙醇或CCl4均可提取碘水中的碘单质
B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同
C.PCl3和Na2O2中各原子或离子最外层都满足8电子稳定结构
D.24Mg34S晶体中电子总数与中子总数之比为1∶1
难度: 简单查看答案及解析
-
根据有机化合物的命名原则,下列命名正确的是( )
A.
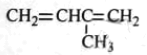 3-甲基-1,3-丁二烯
3-甲基-1,3-丁二烯B.
 2-羟基丁烷
2-羟基丁烷C.CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷
D.CH3CH(NH2)CH2COOH 3-氨基丁酸
难度: 简单查看答案及解析
-
通常情况下,前者无法决定后者的是
A.原子的核外电子排布----元素的金属性强弱
B.化合物的内在结构----电解质的相对强弱
C.反应温度的高低----化学平衡的移动程度
D.反应物的化学性质----化学反应速率的快慢
难度: 简单查看答案及解析
-
下列离子组一定能大量共存的是
A.能使pH试纸显红色的溶液中:Na+、NH4+、I-、NO3-
B.含有0.1 mol/LFe3+ 的溶液中:K+、Mg2+、S2-、SO42-
C.由水电离出来的c(H+) = 1×10-13 mol/L的溶液中:K+、CO32-、Cl-、NO3-
D.常温下,
的溶液:Na+、K+、CO32-、NO3-
难度: 中等查看答案及解析
-
右图是反应CO(g)+2H2(g) → CH3OH(g)进行过程中的能量变化曲线。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。下列相关说法正确的是
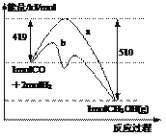
A.该反应是吸热反应
B.使用催化剂后反应热减小
C.热化学方程式为CO(g)+2H2(g) → CH3OH(g) + 510 kJ
D.热化学方程式为CO(g)+2H2(g) → CH3OH(g) + 91 kJ
难度: 简单查看答案及解析
-
室温下,对于0.1mol/L的氨水,下列判断正确的是
A.用相同浓度的硝酸中和该氨水,硝酸体积小于氨水时,溶液可能呈中性
B.温度不变,加水稀释后溶液中c(NH4+)·c(OH-)不变
C.加水稀释后,溶液中导电粒子的数目减少
D.该溶液的pH=13
难度: 中等查看答案及解析
-
如图表示水溶液中c(H+)和c(OH-)的关系,下列说法正确的是

A.ab线上任意点溶液均显中性
B.b点时,溶液的pH=6,显酸性
C.图中温度T1>T2
D.在水中通入适量HCl气体可从a点变到c点
难度: 中等查看答案及解析
-
对于常温下的溶液,叙述正确的是( )
A.某氨水溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a<b
B.若1mL pH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
C.在滴有酚酞溶液的氨水里,加入盐酸至恰好呈无色,则此时溶液的pH=7
D.1.0×10-6mol/L盐酸的pH=6,1.0×10-8mol/L盐酸的pH=8
难度: 简单查看答案及解析
-
下列溶液中通入SO2一定不会产生沉淀的是
A.Ba(OH)2 B.Ba(NO3)2 C.Na2S D.BaCl2
难度: 中等查看答案及解析
-
阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定正确的是( )
A.1L 1 mol·L-1的CH3COOH溶液中含有氢离子数约为6.02×1023
B.18g D2O(重水)完全电解,转移的电子数约为6.02×1023
C.34 g H2O2中含有的阴离子数为约为6.02×1023
D.STP下,14g乙烯和丙烯的混合物中,含有共用电子对数目约为3×6.02×1023
难度: 中等查看答案及解析
-
原电池与电解池在生活中和生产中有着广泛应用。下列有关判断中错误的是( )
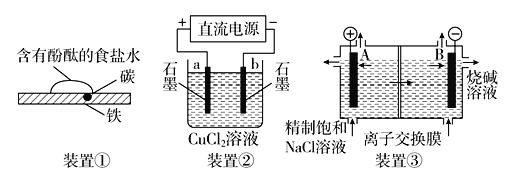
A.装置①研究的是金属的吸氧腐蚀,Fe上的反应为Fe-2e-===Fe2+
B.装置②研究的是电解CuCl2溶液,它将电能转化为化学能
C.装置③研究的是电解饱和食盐水,电解过程中,B极上发生氧化反应
D.三个装置中涉及的主要反应都是氧化还原反应
难度: 中等查看答案及解析
-
取一定量的氧化铁与氧化铜的混合物,加入稀硫酸(含0.1 mol H2SO4),恰好完全反应成盐和水,原混合物中氧元素的质量是
A.6.4g B.3.2g C.1.6g D.0.8g
难度: 中等查看答案及解析
-
下列相关实验中,由“操作和现象”得出的“结论”正确的是( )
操作和现象
结论
A
取某溶液少许,加入酸化的Ba(NO3)2溶液,产生白色沉淀
该溶液一定含SO42-
B
向纯碱溶液中滴加足量稀盐酸,将产生的气体通入苯酸钠溶液中,溶液变混浊
酸性:盐酸>碳酸>苯酚
C
某溶液加入盐酸产生能使澄清石灰水变浑浊的气体
该溶液中一定含CO32-或SO32-
D
取少量Fe(NO3)2试样加稀硫酸溶解,滴加KSCN溶液,溶液变红色
该Fe(NO3)2试样已经变质
A.A B.B C.C D.D
难度: 中等查看答案及解析