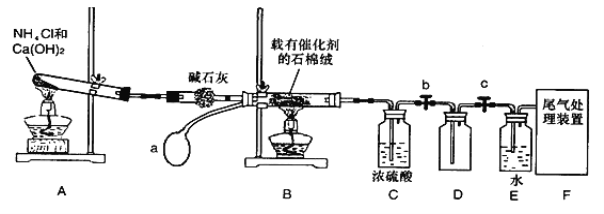
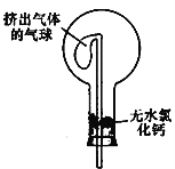
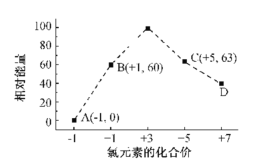
-
下列物质变化或操作过程中发生化学变化的是
A. 硅胶作袋装食品的干燥剂 B. 氯气作自来水杀菌消毒剂
C. 用铂丝蘸取碳酸钠溶液在酒精灯外焰上灼烧 D. 用蒸馏的方法除去自来水中的Cl-
难度: 中等查看答案及解析
-
下列能用分液漏斗进行分离的混合物是( )
A. 四氯化碳和水 B. 酒精和汽油 C. 碘和四氯化碳 D. 汽油和植物油
难度: 中等查看答案及解析
-
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2↑+9H2O,在反应中被氧化与被还原的氮原子数之比是( )
A. 5:4 B. 4:5 C. 5:3 D. 3:5
难度: 中等查看答案及解析
-
下列对浓硫酸的叙述正确的是( )
A. 常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸
B. 浓硫酸具有吸水性,故能使蔗糖炭化
C. 浓硫酸和铜片加热既表现出酸性,又表现出氧化性
D. 浓硫酸与亚硫酸钠反应制取SO2时,浓硫酸表现出强氧化性
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.标准状况下,22.4 L SO3含有的分子数为NA
B.1mol氯气与足量铁粉充分反应,转移的电子数为3NA
C.16 g O2和O3的混合气体中含氧原子数目为NA
D.1mol/LNa2CO3溶液中含有Na+数目为2NA
难度: 中等查看答案及解析
-
我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿滴,惟玻璃可盛。”这里的“强水”是指( )
A.氨水 B.卤水 C.醋 D.硝酸
难度: 简单查看答案及解析
-
1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一。下列有关元素周期表的说法正确的是( )
A.元素周期表含元素最多的族是第ⅢB族
B.元素周期表有18个族
C.第ⅠA族的元素全部是金属元素
D.短周期是指第一、二、三、四周期
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
B.向FeCl3溶液中加入几滴KSCN溶液:3SCN-+Fe3+=Fe(SCN)3↓
C.稀硫酸和氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
D.碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O
难度: 中等查看答案及解析
-
下列药品和装置合理且能完成相应实验的是( )
A.
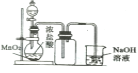 实验室制氯气
实验室制氯气B.
 实验室制取并收集氨气
实验室制取并收集氨气C.
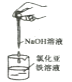 制备氢氧化亚铁
制备氢氧化亚铁D.
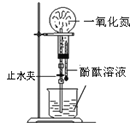 观察喷泉实验
观察喷泉实验难度: 中等查看答案及解析
-
三种正盐的混合溶液中含有0.2molNa+,0.25molMg2+,0.4molCl﹣,则溶液中SO42﹣的物质的量为
A.0.1 mol B.0.3 mol C.0.5 mol D.0.15 mol
难度: 中等查看答案及解析
-
下列实验过程中产生的现象与对应的图形相符的是( )
A.
 NaHSO3 粉末加入HNO3溶液中 B.
NaHSO3 粉末加入HNO3溶液中 B. SO2气体通入新制氯水中
C.
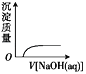 NaOH溶液滴入 Ba(HCO3)2溶液中 D.
NaOH溶液滴入 Ba(HCO3)2溶液中 D. 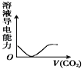 CO2气体通入澄清石灰水中
CO2气体通入澄清石灰水中难度: 中等查看答案及解析
-
下列各组元素性质递变情况错误的是( )
A.H、Be、B原子最外层电子数依次增多 B.P、S、Cl元素最高正化合价依次升高
C.B、C、N、O、F原子半径依次增大 D.Li、Na、K、Rb的金属性依次增强
难度: 中等查看答案及解析
-
A、B、C均为短周期元素,它们在周期表中的位置如图所示,已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C符合的一组是( )
A.Be、Na、Al B.B、Mg、Si
C.O、P、Cl D.C、Al、P
难度: 简单查看答案及解析
-
短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中T所处的周期序数与族序数相等。下列有关说法错误的是( )
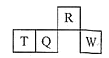
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. T的单质是两性物质
难度: 中等查看答案及解析
-
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
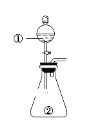
选项
①中物质
②中物质
预测②中的现象
A
稀盐酸
碳酸钠与氢氧化钠的混合溶液
立即产生气泡
B
浓硝酸
用砂纸打磨过的铝条
产生红棕色气体
C
氯化铝溶液
浓氢氧化钠溶液
产生大量白色沉淀
D
草酸溶液(H2C2O4具有还原性)
高锰酸钾酸性溶液
溶液逐渐褪色
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
4.6g铜镁合金完全溶解于100mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到4480mLNO2和336 mLN2O4的混合气体(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液至离子恰好全部沉淀时,下列说法不正确的是
A.该合金中铜与镁的物质的量之比是46:69
B.该浓硝酸中HNO3的物质的量浓度是14.0mol·L-1
C.产生沉淀8.51 g
D.离子恰好完全沉淀时,加入NaOH溶液的体积是230mL
难度: 中等查看答案及解析