-
用98%的浓硫酸配制1.0mol·L-1的稀硫酸时,下列操作会导致溶液浓度偏高的是
A. 用量筒量取浓硫酸时,俯视量筒读数量取
B. 在烧杯中溶解时,有少量液体溅出
C. 使用容量瓶时,容量瓶内残留有少量水分
D. 定容时俯视容量瓶刻度线
难度: 中等查看答案及解析
-
下列有关离子(或物质)的检验及结论,正确的是( )
A.用丁达尔效应可鉴别NaCl溶液和Fe(OH)3胶体
B.焰色反应实验中,透过蓝色钴玻璃,可观察到Na+离子火焰呈黄色
C.检验Na2CO3固体中是否混有NaHCO3,可向固体中直接滴加稀盐酸,如果观察到立刻有气体产生,说明混有NaHCO3
D.向某无色溶液中加入BaCl2溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有SO42-
难度: 简单查看答案及解析
-
下列转化过程不能一步实现的是
A. Al(OH)3→Al2O3 B. Al2O3→Al(OH)3
C. Al→AlCl3 D. Al→NaAlO2
难度: 简单查看答案及解析
-
向氧化铁、氧化铜、铁、铜的混和粉末中加入过量的稀盐酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是( )
A.只有Fe2+和Cu2+ B.一定有Fe2+、Cu2+,可能有Fe3+
C.一定有Fe2+,可能有Cu2+ D.只有Fe2+
难度: 简单查看答案及解析
-
今有x、y、z、w四种元素的微粒,彼此间能发生如下反应:Cl2+2Br-=2Cl-+Br2 ; 2Fe3+ + 2I-=2Fe2+ + I2 ; Br2 + 2Fe2+= 2Fe3++ 2Br-其中氧化剂的氧化能力由强到弱的顺序为( )
A.Cl2>Br2>Fe3+>I2 B.Cl2>Fe3+>I2>Br2 C.Cl2> I2>Fe3+> Br2 D.Br2>Fe3+>I2 >Cl2
难度: 简单查看答案及解析
-
下列说法正确的是
①标准状况下,6.02×1023个分子所占的体积约是22.4 L
②0.5 mol H2所占体积为11.2 L
③标准状况下,1 mol H2O的体积为22.4 L
④常温常压下,28 g CO与N2的混合气体所含的原子数为2NA
⑤各种气体的气体摩尔体积都约为22.4 L·mol−1
⑥标准状况下,体积相同的气体的分子数相同
A.①③⑤ B.④⑥ C.③④⑥ D.①④⑥
难度: 简单查看答案及解析
-
如表分类正确的是( )
选项
单质
酸
碱
胶体
A
水银
硝酸
纯碱
蛋白质溶液
B
溴水
磷酸
烧碱
烟
C
C60
醋酸
熟石灰
雾
D
臭氧
碳酸
氢氧化铜
氢氧化铁沉淀
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列离子能大量共存的是( )
A. 能使无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32-
B. 无色透明的溶液中:Cu2+、K+、SO42-、NO3-
C. 含有大量Ba(NO3)2的溶液中:Mg2+、NH4+、SO42-、Cl-
D. 能使紫色石蕊试液呈红色的溶液中:Ca2+、K+、HCO3-、NO3-
难度: 中等查看答案及解析
-
在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O的反应中,被还原的硝酸的物质的量与未被还原的硝酸的物质的量之比为( )
A.1:2 B.1:3 C.3:1 D.1:4
难度: 简单查看答案及解析
-
类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知
类推
A
将Fe加入CuSO 4 溶液中
Fe+Cu 2+ =Cu+Fe 2+
将Na加入到CuSO 4 溶液中
2Na+Cu 2+ =Cu+2Na +
B
铁和氯气反应2Fe+3Cl 2
2FeCl 3
镁和氯气反应Mg + Cl 2
MgCl 2
C
稀硫酸与NaOH溶液反应至中性
H + +OH - =H 2 O
稀硫酸与Ba(OH)2溶液反应至中性
H + +OH - =H 2 O
D
向AlCl 3溶液中加入过量NaOH溶液
Al3+ +4OH- = AlO2- +2H2O
向AlCl 3溶液中加入过量氨水
Al3+ +4OH- = AlO2- +2H2O
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
为了除去KCl固体中少量MgSO4和CaCl2杂质,需进行下列六项操作:①加水溶解;②加热蒸发得到晶体;③加入过量BaCl2溶液;④加入过量盐酸;⑤加入过量K2CO3溶液;⑥过滤;⑦加入过量KOH正确的顺序是( )
A.①⑤③⑦⑥④② B.①③⑦⑤⑥④②
C.①⑦③④⑥⑤② D.①⑦⑤③④⑥②
难度: 困难查看答案及解析
-
某白色粉末由两种物质组成,为鉴别其成分进行如下实验:①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。该白色粉末可能为( )
A.NaHCO3、NaOH B.AgCl、NaHCO3
C.Na2SO3、BaCO3 D.Na2CO3、CuSO4
难度: 中等查看答案及解析
-
500mL的KAl(SO4)2溶液中含有3.9g的K+,则该溶液中c(SO42-)为( )
A.1mol/L B.0.4mol/L C.0.2mol/L D.0.1mol/L
难度: 简单查看答案及解析
-
已知ag的A2气体含有n个分子,则mg的A2气体在标准状况下的体积为(设N为阿伏加德罗常数)( )
A.22.4L B.
L C.
L D.
L
难度: 简单查看答案及解析
-
将0.8g NaOH和1.06g Na 2CO 3混合并配成溶液,向溶液中滴加0.1 mol·L -1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO 2的物质的量的关系的是( )
A.
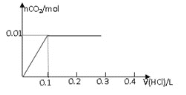
B.
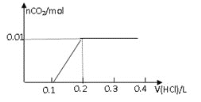
C.
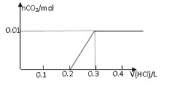
D.
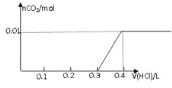
难度: 困难查看答案及解析
-
将2.8g铁粉加入50mL3mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉有剩余,溶液呈浅绿色
B.往溶液中滴入KSCN溶液,不显血红色
C.氧化产物和还原产物的物质的量之比为2∶1
D.Fe2+和Fe3+物质的量之比为3∶1
难度: 中等查看答案及解析
-
认识反应条件对化学反应的影响,对学好化学具有重要意义。下列说法中正确的是( )
A.铝在空气中或纯氧中燃烧,主要产物都是Al2O3
B.钠在空气中缓慢氧化或在空气中燃烧,产物都是Na2O2
C.铁片在常温下与稀硫酸或浓硫酸反应,都生成FeSO4
D.镁在空气中或纯氧中燃烧,产物都只有MgO
难度: 简单查看答案及解析
-
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气,下列关于Na2O2的叙述正确的是( )
①Na2O2中阴、阳离子的个数比是1:1
②Na2O2分别与水及CO2反应产生等量氧气时,转移电子的物质的量相等
③Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色
④Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑤Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
A.①③⑤ B.②③⑤ C.①②⑤ D.①④⑤
难度: 简单查看答案及解析
-
下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是①Al2O3②NaHSO4③NaHCO3④Al(OH)3⑤Na2CO3( )
A.①③④ B.②③⑤ C.②④⑤ D.①②④
难度: 简单查看答案及解析
-
下列有关Na2CO3和NaHCO3的说法错误的是
A.等质量Na2CO3和NaHCO3分别和足量盐酸反应,相同条件下前者生成CO2少
B.将石灰水分别加入NaHCO3和Na2CO3中,前者不生成沉淀
C.相同条件下Na2CO3比NaHCO3更易溶于水
D.Na2CO3固体中含少量NaHCO3,可用加热法除去
难度: 简单查看答案及解析
-
合金比纯金属制成的金属材料的优点是( )
①合金的硬度一般比它的各成分金属的大
②一般地,合金的熔点比它的各成分金属的更低
③改变原料的配比、改变生成合金的条件,得到有不同性能的合金
④合金比纯金属的导电性更强
⑤合金比纯金属的应用范围更广泛
A.①②③⑤ B.②③④ C.①②④ D.①②④⑤
难度: 简单查看答案及解析
-
下列各组物质发生化学反应时,由于反应物的量不同而生成不同产物的是( )
①CO2与NaOH溶液②NaHCO3溶液与盐酸③Na与氧气④C与O2⑤AlCl3溶液与氨水
A.①②③ B.①④ C.②⑤ D.①③④
难度: 简单查看答案及解析
-
把图b的碎纸片补充到图a中,可得到一个完整的离子方程式。下列有关该离子方程式的说法正确的是( )
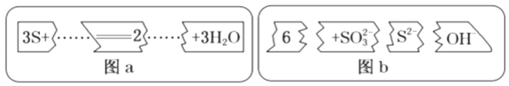
A.配平后的化学计量数依次为3、1、2、6、3
B.若有1molS被氧化,则生成2molS2-
C.氧化剂与还原剂的物质的量之比为1:2
D.3molS参加反应有8mol电子发生转移
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.1molO2与金属Na反应,O2一定得到4NA个电子
B.18gNH4+中所含的电子数为11NA
C.1molFe与足量的Cl2反应,转移的电子数为2NA
D.1molCl2与足量的Fe反应,转移的电子数为2NA
难度: 简单查看答案及解析