-
下列物质中,含有共价键的离子化合物的是
A.Na2O B.MgCl2 C.NaOH D.H2O
难度: 简单查看答案及解析
-
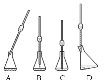
下列仪器中不能用于物质分离的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
既不是电解质,又不是非电解质的是
A.铜 B.二氧化硫 C.葡萄糖 D.冰醋酸
难度: 简单查看答案及解析
-
下列反应中,氧化剂与还原剂为同一种物质的是
A.SO2+2H2S=3S↓+H2 B.2NO2+2NaOH=NaNO2+NaNO3+H2O
C.Zn+2HCl=ZnCl2+H2↑ D.MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
难度: 中等查看答案及解析
-
下列物质的名称不正确的是
A.熟石灰:CaO B.熟石膏:2CaSO4·H2O
C.蚁酸:HCOOH D.硬脂酸钠:C17H35COONa
难度: 简单查看答案及解析
-
下列表示正确的是
A.过氧化钠的电子式:Na:
:
:Na B.钠离子的结构示意图
C.乙炔的结构简式CHCH D.CO2的比例模型

难度: 简单查看答案及解析
-
下列说法不正确的是
A.白磷和红磷互为同素异形体 B.
和
互为同系物
C.H 和 D互为同位素 D.CH3COOH与HCOOCH3互为同分异构体
难度: 简单查看答案及解析
-
下列说法不正确的是
A.氢氧化铝和苏打都可以用于治疗胃酸过多 B.晶体硅可科用于制造半导体材料
C.可以用丁达尔效应区分氢氧化铁胶体和氯化钠溶液 D.游泳场馆常用硫酸铜作池水消毒剂
难度: 简单查看答案及解析
-
下列说法正确的是
A.某些植物具有富集溴的能力,从海产品中提取溴是工业上获取溴的重要途径
B.工业炼铁需要用到的原料有铁矿石、焦炭、空气和熟石灰
C.冶炼镁时,将六水合氯化镁晶体直接加热分解可得纯净无水氯化镁
D.我国古代就已知晓采用加热胆矾或绿矾的方法制取硫酸
难度: 中等查看答案及解析
-
下列说法正确的是
A.乙烯、氯乙烯、聚氯乙烯均能使溴水褪色
B.石油裂解可以提高轻质油的产量和质量
C.燃烧等物质的量的乙烯、乙醇,消耗氧气的量相同
D.甲烷的一氯代物只有一种结构能够证明甲烷分子的空间构型为正四面体
难度: 中等查看答案及解析
-
下列关于实验原理或操作的叙述中,不正确的是
A.纸层析实验中,须将滤纸上的试样点浸入展开剂中
B.可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油
C.从碘水中提取单质碘时,不能用无水乙醇代替CCl4
D.实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法
难度: 中等查看答案及解析
-
下列关于氮及其化合物,说法不正确的是
A.氮气是空气中含量最高的气体,性质比较稳定
B.“光化学烟雾”、“硝酸酸雨”的形成都与氮氧化物有关
C.工业硝酸往往会发黄,因为其中含有Fe3+
D.常温下,浓硝酸可以利用铁罐车进行运输
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.食醋除去水垢中的碳酸钙:CaCO3+2H+=Ca2++CO2↑+H2O
B.小苏打治疗胃酸过多的反应:CO32-+2H+= CO2↑+H2O
C.苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH+HCO3-
D.碳酸氢铵溶液与过量氢氧化钠溶液反应:NH4++OH‾=NH3↑+H2O
难度: 中等查看答案及解析
-
下列说法正确的是
A.油脂水解可得到氨基酸和甘油
B.结构片段
的高聚物,其单体是苯酚和甲醛
C.检验淀粉在稀硫酸条件下水解产物的方法是:取适量水解液于试管中,加入少量新制 Cu(OH)2 悬浊液,加热,观察是否有砖红色沉淀
D.鸡蛋清溶液中加入饱和硫酸铵溶液、饱和硫酸铜溶液均会发生盐析而凝聚
难度: 中等查看答案及解析
-
乙烯雌酚是人工合成的激素类药物,对垂体促性腺激素的分泌有抑制作用,能改善体内激素的平衡状态,破坏肿瘤组织赖以生长发育的条件,对治疗前列腺癌和乳腺癌有明显的疗效,其结构如下:
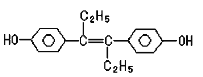
下列有关叙述中正确的是:
A.乙烯雌酚的分子式为C18H22O2 B.乙烯雌酚可与NaOH和NaHCO3发生反应
C.1mol该有机物可以与7mol Br2发生反应 D.该有机物分子中一定有8个碳原子共平面
难度: 中等查看答案及解析
-
W、X、Y、Z 四种短周期元素在元素周期表中的相对位置如下表所示,W、X、Y、Z原子的最外层电子数之和为 21,下列说法中不正确的是
W
X
Y
Z
A.氧化物对应水化物的酸性:Z>Y B.简单阴离子的还原性:Z>W
C.气态氢化物的稳定性:W>Y D.原子半径:X>Y>W
难度: 中等查看答案及解析
-
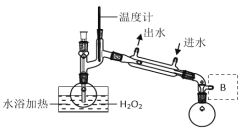
液体燃料电池相比于气体燃料电池具有体积小、无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,氢氧化钾作为电解质。下列关于该燃料电池的叙述不正确的是( )
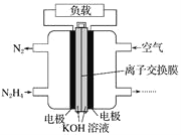
A.电流从右侧电极经过负载后流向左侧电极
B.负极发生的电极反应式为:N2H4+4OH--4e-=N2↑+4H2O
C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D.该燃料电池持续放电时,钾离子从负极向正极迁移,需选用阳离子交换膜
难度: 中等查看答案及解析
-
下图为反应 2H2(g)+O2(g)=2H2O(g)的能量变化示意图。 下列说法正确的是
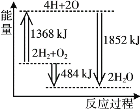
A.拆开 2 mol H2(g)和 1 mol O2(g)中的化学键成为H、O原子,共放出1368 kJ 能量
B.由 H、O 原子形成 2 mol H2O(g),共吸收1852 kJ 能量
C.2 mol H2(g)和 1 mol O2(g)反应生成 2 mol H2O(g),共放出484 kJ 能量
D.2 mol H2(g)和 1 mol O2(g)反应生成 2 mol H2O(l),ΔH>-484 kJ·mol-1
难度: 简单查看答案及解析
-
下列说法不正确的是
A.0.1mol·L−1NaOH溶液从常温升温到60℃,其pH变小
B.等浓度的氨水、NaOH溶液加入稀盐酸至中性,则c(NH4+)=c(Na+)
C.等浓度的氨水、NaOH溶液稀释相同的倍数,pH后者大
D.等体积、等pH的氨水、NaOH溶液加入足量的AlCl3溶液,产生沉淀的质量前者大
难度: 中等查看答案及解析
-
下列说法正确的是
A.在熔融状态能导电的物质一定是离子化合物
B.CO2和CS2每个原子的最外层都具有8电子稳定结构
C.干冰和石英晶体中的化学键类型相同,熔化时需克服微粒间的作用力类型也相同
D.2016年IUPAC命名117号元素为Ts,Ts的原子核外最外层电子数是7,是第七周期第ⅦB族元素
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,11.2LCCl4中含有C-Cl键的数目为1.5NA
B.7.8g苯中含碳碳单键的数目为0.3NA
C.1L0.1mol·L−1硫酸钠溶液中含有的氧原子数为0.4NA
D.常温下,14g乙烯和丙烯混合气体中的氢原子数为2NA
难度: 中等查看答案及解析
-
600℃时,在 2 L 的恒容密闭容器中充入一定量的 CO 和 H2O,发生反应: CO (g)+H2O (g)
CO2(g)+H2 (g)。反应过程中的部分数据如下表所示:
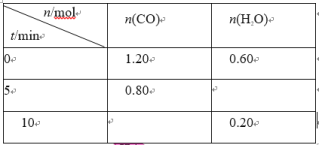
下列说法正确的是
A.0~5 min 用 CO 表示的平均反应速率为 0.08mol·L−1·min−1
B.该反应在 10 min 后才达到平衡
C.温度升高至 800℃时,反应平衡常数为 0.64,则正反应为吸热反应
D.保持其他条件不变,起始时向容器中充入 0.60 molCO 和 1.20 molH2O,达到平衡时 n(CO2)=0.4mol
难度: 中等查看答案及解析
-
在25℃时,向l0mL0.01mol•L﹣1NaA溶液中逐滴加入0.01mol•L﹣1的盐酸,滴定曲线如图所示,下列说法正确的是( )
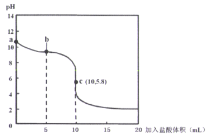
A. a点到c点的过程中,c(HA)+C(A﹣)=0.01mol•L﹣1等式始终成立
B. b点时,溶液中微粒浓度大小的关系:c(A﹣)>c(Cl﹣)>c(HA)>c(OH﹣)>c(H+)
C. c点溶液存在的关系:c(Na+)+c(H+)=c(HA)+c(OH ﹣)+2c(A﹣)
D. 由图可知,等浓度的HA、NaA混合溶液中,HA的电离程度大于A﹣的水解程度
难度: 困难查看答案及解析
-
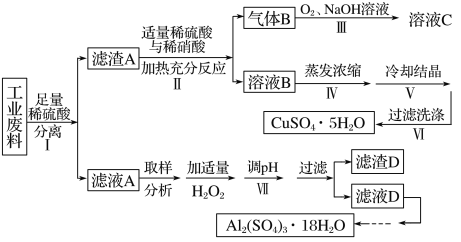
利用铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体(CuSO4•5H2O):
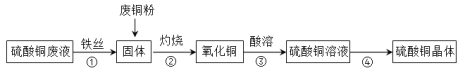
下列说法不正确的是
A.步骤①主要是利用铁丝把铜从溶液中还原出来
B.步骤②灼烧固体所用的仪器可以是坩埚
C.步骤③酸溶所用的酸是稀硫酸
D.浓硫酸可使硫酸铜晶体脱去结晶水,浓硫酸表现出脱水性
难度: 中等查看答案及解析
-
常温下,某澄清透明的溶液中可能存在:Fe2+、Cu2+、Mg2+、SO32-、Br-、SO42-等离子中的一种或几种,现进行如下实验:

下列说法不正确的是:
A.溶液中一定不存在Mg2+、Cu2+ B.溶液中一定不存在SO32-
C.溶液中一定存在Fe2+、Br-、SO42- D.沉淀B中可能含有氢氧化镁,肯定含有氢氧化铁
难度: 中等查看答案及解析

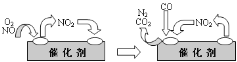

 (R表示烃基,R'和R"表示烃基或氢)
(R表示烃基,R'和R"表示烃基或氢) 和CH3CH2CH2OH为原料制备
和CH3CH2CH2OH为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)__________。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)__________。