-
下列液体均处于25℃,有关叙述正确的是
A.某物质的溶液pH < 7,则该物质一定是酸或强酸弱碱盐
B.pH= 4.5的番茄汁中c(H+)是pH= 6.5的牛奶中c(H+)的100倍
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D.pH= 5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) > c(CH3COO-)
难度: 中等查看答案及解析
-
有①②③三瓶体积相等,浓度都是1 mol/L的HCl溶液,将①加热蒸发体积至体积减少一半,在②中加入少量CH3COONa固体,加入后溶液仍呈强酸性,③不作改变。然后以酚酞做指示剂,用NaOH溶液滴定上述三种溶液,可观察到所消耗的NaOH溶液体积是( )
A.①=③>② B.③>②>① C.③=②>① D.①=②=③
难度: 中等查看答案及解析
-
氯水中存在平衡Cl2+H2O
HCl+HClO,HClO
H++ClO-。达平衡后,要使HClO浓度增大,可加入( )
A.H2S B.NaHCO3 C.盐酸 D.NaOH
难度: 中等查看答案及解析
-
在25℃时,用蒸馏水稀释1 mol/L氨水至0.01 mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是( )
A.
B.c(H+)·c(OH-)
C.
D.c(OH-)
难度: 中等查看答案及解析
-
将0.01mol下列物质分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
①Na2O2②Na2O ③Na2CO3④NaCl
A.①>②>③>④ B.①>②>④>③
C.①=②>③>④ D.①=②>③=④
难度: 简单查看答案及解析
-
已知AgI为黄色沉淀,AgCl为白色沉淀。25°C时,AgI饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5 mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01mol·L-1的AgNO3溶液,则下列叙述中不正确的是 ( )
A.溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3-)>c(Cl-)>c(I-)>c(Ag+)
B.溶液中先产生的是AgI沉淀
C.AgCl的Ksp的数值为1.69×10-10
D.若在AgI悬浊液中滴加少量的KCl溶液,黄色沉淀不会转变成白色沉淀
难度: 困难查看答案及解析
-
下列叙述正确的是
A.常温下,pH值等于14与pH值等于12的两种NaOH溶液等体积混和后,c(H+)=(10-14+10-10)/2
B.常温下,浓度为1×10-10mol/L的KOH溶液的pH值最接近于4
C.氨水加水稀释,溶液中除水以外的所有粒子的浓度都减小
D.常温下,相同温度下pH值等于1的盐酸溶液中水的电离程度与pH值等于13的Ba(OH)2溶液中水的电离程度相等
难度: 中等查看答案及解析
-
pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
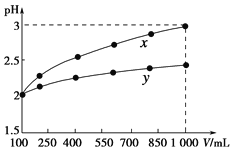
A.x为弱酸,Vx<Vy B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy D.y为强酸,Vx>Vy
难度: 中等查看答案及解析
-
常温下,在20.00 mL 0.100 0 mol·L-1NH3·H2O溶液中逐滴滴加0.100 0 mol·L-1HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是( )
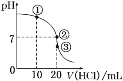
A.①溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.②溶液:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C.①、②、③三点所示的溶液中水的电离程度②>③>①
D.滴定过程中不可能出现:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
难度: 困难查看答案及解析
-
下列有关电解质溶液的说法正确的是( )
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中
增大
C.向盐酸中加入氨水至中性,溶液中
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中
不变
难度: 中等查看答案及解析
-
人体血液里存在重要的酸碱平衡:
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随
变化关系如下表:
1.0
17.8
20.0
22.4
pH
6.10
7.35
7.40
7.45
下列说法不正确的是
A. 正常人体血液中,
的水解程度大于电离程度
B. 人体血液酸中毒时,可注射
溶液缓解
C.
的血液中,
D. pH=7.40的血液中,
的水解程度一定大于
的电离程度
难度: 中等查看答案及解析
-
浓度均为0.10mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg
的变化如图所示,下列叙述错误的是( )
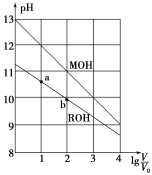
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg
=2时,若两溶液同时升高温度,则
增大
难度: 中等查看答案及解析
-
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下.下列说法正确的是( )
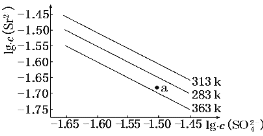
A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
B.三个不同温度中,313K时Ksp(SrSO4)最小
C.283K时,图中a点对应的溶液是不饱和溶液
D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
难度: 中等查看答案及解析
-
下列溶液中各微粒的浓度关系正确的是
A.pH相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液,NH4+大小顺序为①>②>③
B.pH相等的NaF与CH3COOK溶液:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)]
C.0.2 mol·L-1的Na2CO3溶液: c(OH-)=c(HCO3—)+c(H+)+c(H2CO3)
D.0.2 mol·L-1HCl与0.1 mol·L-1NaAlO2溶液等体积混合:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-)
难度: 困难查看答案及解析
-
根据下列图示所得出的结论不正确的是
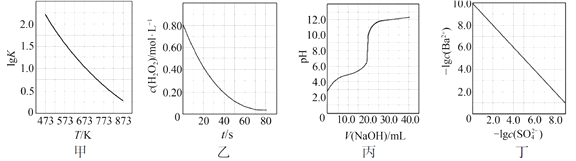
A.图甲是CO(g)+H2O(g)
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B.图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C.图丙是室温下用0.1000 mol·L−1NaOH溶液滴定20.00 mL 0.1000 mol·L−1某一元酸HX的滴定曲线,说明HX是一元强酸
D.图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42−)的关系曲线,说明溶液中c(SO42− )越大c(Ba2+ )越小
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.向固体Mg(OH)2存在的饱和溶液中加入NH4Cl固体,能使Mg(OH)2固体减少
B.为了避免电解液中CuSO4因水解而产生沉淀,可加入适量稀硫酸抑制水解
C.在蒸发皿中加热蒸干碳酸钠溶液,可以得到碳酸钠固体
D.溶液导电过程是电解的过程,强电解质的导电能力一定比弱电解质的导电能力强
难度: 中等查看答案及解析
-
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2,溶解或电离出S2-的能力为FeS>H2S>CuS,下列离子方程式错误的是( )
A.Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
B.Cu2++H2S=CuS↓+2H+
C.Zn2++S2-+2H2O=Zn(OH)2↓+H2S↑
D.FeS+2H+=Fe2++H2S↑
难度: 中等查看答案及解析