-
化学与生活息息相关。下列说法错误的是
A.铝合金大量用于高铁建设 B.活性炭具有除异味和杀菌作用
C.生石灰可用作袋装食品干燥剂 D.光束通过云、雾会产生丁达尔效应
难度: 简单查看答案及解析
-
用化学用语表示Cl2 +H2O =HCl+HClO中的相关微粒,其中正确的是
A.中子数为10的氧原子:
B.HCl的电子式:
C.HClO 的结构式: H-Cl-O D.Cl-的结构示意图:
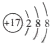
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A.细铁粉具有还原性,可用作食品抗氧剂 B.NaHCO3受热易分解,可用于制胃酸中和剂
C.漂白粉在空气中不稳定,可用于漂白纸张 D.Al2O3是两性氧化物,可用作耐高温材料
难度: 简单查看答案及解析
-
含锂材料在社会生产与生活中应用广泛,如6Li和7Li用作核反应堆最佳热载体7LiH 和7LiD用作高温堆减速剂。下列说法正确的是
A.7LiH和7LiD互为同素异形体 B.7LiH和7LiD的化学性质不同
C.6Li和7Li核外电子排布方式相同 D.通过化学变化可以实现6Li与7Li间的相互转化
难度: 简单查看答案及解析
-
根据元素周期表及元素周期律,下列推断正确的是
A.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
B.第VA族元素的非金属性自上而下依次减弱
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.第三周期金属元素的化合价越高,其原子失电子能力越强
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1 mol /L K2SO4溶液中含有的K+数为0.2NA
B.标准状况下,11.2L H2O中含有的分子数为0.5NA
C.32g由O2和O3组成的混合气体中含有的原子数为2NA
D.1mol Cl2与足量的铁粉完全反应,转移的电子数为3NA
难度: 简单查看答案及解析
-
《天工开物》记载:“凡火药以硝石、硫磺为主,草木灰为辅 而后火药成声”的主要反应为S+2KNO3+3C =K2S+3CO2 ↑+N2↑.下列说法错误的是( )
A.硝石的主要成分为硝酸盐 B.硫磺在反应中作氧化剂
C.火药可用于制作烟花爆竹 D.每消耗1 mol KNO3,该反应转移5 mol电子
难度: 简单查看答案及解析
-
在无色透明的强酸性溶液中,下列各组离子能大量共存的是( )
A.K+、Fe2+、ClO- 、NO3- B.Na+、Ca2+、NO3-、CO32-
C.Mg2+、Al3+、Cl-、SO42+ D.Ba2+、NH4+、Cl-、HCO3-
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.用醋酸除去水垢: 2H++CO32- = CO2↑+H2O
B.向FeC13溶液中加入过量铁粉: Fe3++Fe=2Fe2+
C.钠与水反应: Na+2H2O=Na++2OH- +H2↑
D.用管道疏通剂(主要成分为Al粉和NaOH固体)疏通管道:2A1+2H2O+2OH-=2A1O2-+3H2↑
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化不能实现的是( )
A.Fe(s)
FeCl3(s)
Fe(OH)3(s)
B.CaCl2(aq)
CaCO3(s)
CaO(s)
C.NaHCO3(s)
Na2CO3(s)
NaOH(s)
D.Al2O3(s)
AlCl3(aq)
Al(OH)3 (s)
难度: 简单查看答案及解析
-
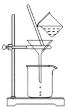
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如下图所示,Y的原子序数是X的2倍,由此可知
W
X
Y
Z
A.原子半径: Z>Y>X B.Y的单核阴离子还原性比X的强
C.Z的氧化物对应水化物的酸性一定比Y的强 D.简单氢化物的热稳定性: W>X
难度: 中等查看答案及解析
-
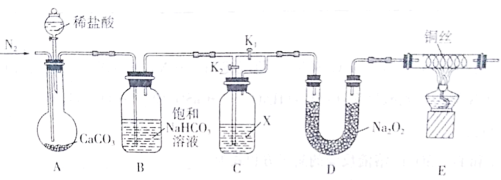
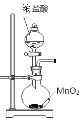
下列装置不能实现相应实验目的的是
A.制取Cl2
 B.除去Cl2中的HCl
B.除去Cl2中的HCl 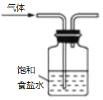
C.收集Cl2
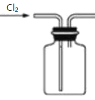 D.处理含Cl2的尾气
D.处理含Cl2的尾气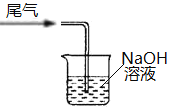
难度: 简单查看答案及解析
-
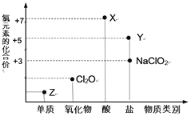
铬元素( Cr)的化合物存在下列转化关系:
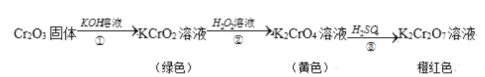
下列判断错误的是
A.反应①表明Cr2O3,具有酸性氧化物的性质
B.反应②利用了H2O2 的氧化性
C.反应③发生的反应为2K2CrO4+H2SO4 =K2Cr2O7+K2SO4+H2O
D.反应①②③中铬元素的化合价均发生了变化
难度: 中等查看答案及解析
-
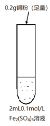
根据下列实验操作和现象所得到的结论正确的是
实验操作
现象
结论
A
将大小相同的K和Na分别放入等体积的水中
钾与水的反应比钠与水剧烈
钾元素的金属性比钠元素强
B
向某溶液中滴加CaCl2溶液
生成白色沉淀
溶液中一定含有CO32-
C
将Cl2通入石蕊试液中
石蕊试液先变红后褪色
Cl2具有漂白性
D
向某黄色溶液中加入淀粉KI溶液
溶液呈蓝色
溶液中一定含有Br2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
在两份相同的H2SO4溶液中,分别滴人物质的量浓度相等的Ba(OH)2、NaOH溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。下列分析正确的是( )
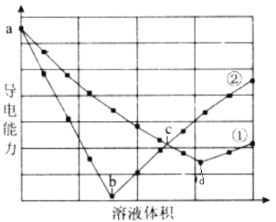
A.①代表滴加Ba(OH)2溶液的变化曲线 B.ab 段发生反应的离子方程式为:OH- +H+=H2O
C.b、d两点对应的溶液均显中性 D.c点对应的两溶液中含有相等量的OH-
难度: 中等查看答案及解析