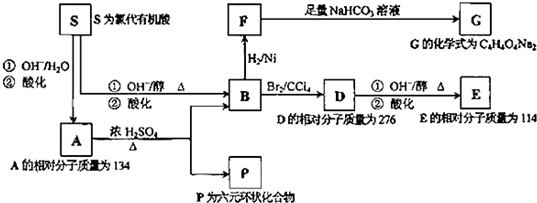
-
对平衡体系CO2(g)⇌CO2(aq)△H=-19.75kJ•mol-1,为了减小温室效应的产生,增大二氧化碳气体在水中的溶解度,应采取的方法是( )
A.升温增压
B.降温减压
C.升温减压
D.降温增压难度: 中等查看答案及解析
-
醋酸溶液中存在电离平衡:CH3 COOH→H++CH3 COO-,下列叙述不正确的是( )
A.CH3 COOH 溶液中离子浓度的关系满足:c(H+)═c(OH-)+c(CH3 COO-)
B.0.1 mol•L-1的CH3 COOH 溶液加水稀释,溶液中c(OH-)减小
C.CH3COOH 溶液中加入少量CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH 溶液与pH=12的NaOH 溶液等体积混合后,溶液的pH<7难度: 中等查看答案及解析
-
二十世纪化学合成技术的发展对人类健康水平和生活质量的提高做出了巨大贡献.下列各组物质全部由化学合成得到的是( )
A.玻璃 纤维素 青霉素
B.尿素 食盐 聚乙烯
C.涤纶 洗衣粉 阿司匹林
D.石英 橡胶 磷化铟难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.1个甘氨酸分子中存在9对共用电子
B.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
C.H2S和CS2分子都是含极性键的极性分子
D.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3
B.NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH-NH3↑+SO32-+2H2O
C.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
D.AgNO3溶液中加入过量的氨水:Ag++NH3•H2O=AgOH+NH4+难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀难度: 中等查看答案及解析
-
下列实验方法合理的是( )
A.可用水鉴别己烷、四氯化碳、乙醇三种无色液体
B.油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离
C.可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等难度: 中等查看答案及解析