-
下列有关晶体和非晶体的说法中正确的是( )
A. 具有规则几何外形的固体均为晶体
B. 晶体具有自范性,非晶体没有自范性
C. 晶体研碎后即变为非晶体
D. 将玻璃加工成规则的固体即变成晶体
难度: 简单查看答案及解析
-
下列各组微粒中不属于等电子体的是
A. CH4、NH4+ B. H2O、HF
C. CO2、N2O D. CO32-、NO3-
难度: 中等查看答案及解析
-
根据“相似相溶”规律和实际经验,下列叙述不正确的是( )
A. 白磷(P4)易溶于CS2,但难溶于水 B. NaCl易溶于水,难溶于CCl4
C. 碘易溶于苯,微溶于水 D. 卤化氢易溶于水,也易溶于CCl4
难度: 简单查看答案及解析
-
下列原子的价电子构型中,第一电离能最小的是( )
A.2s22p4 B.3s23p4 C.4s24p4 D.5s25p4
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.CHCl3是正四面体形
B.H2O分子中氧原子为sp2杂化,其分子几何构型为V形
C.二氧化碳中碳原子为sp杂化,为直线形分子
D. NH4+是三角锥形
难度: 简单查看答案及解析
-
直接由原子构成的一组物质是( )
A.干冰、二氧化硅、金刚石
B.氧化钠、金刚石、氯化氢
C.碘、石墨、氯化钠
D.二氧化硅、金刚石、晶体硼
难度: 简单查看答案及解析
-
下列分子属于手性分子的是
A. H2O B.
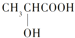 C.
C. 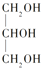 D. H2N﹣CH2﹣COOH
D. H2N﹣CH2﹣COOH难度: 简单查看答案及解析
-
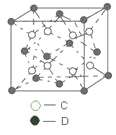
某物质的晶体中,含A
、B
、C
三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出)。晶体中的A、B、C的原子个数比依次为( )
A.1:3:1 B.2:3:1 C.2:2:1 D.1:3:3
难度: 简单查看答案及解析
-
下列分子均属于极性分子且中心原子均为sp3杂化的是()
A.NH3、H2O B.SO2、SCl2 C.PCl3、SO3 D.CH4、P4
难度: 中等查看答案及解析
-
下列中心原子的杂化轨道类型和分子几何构型不正确的是( )
A.PCl3中 P原子sp3杂化,为三角锥形
B.BCl3中B原子sp2杂化,为平面三角形
C.CS2中C原子sp杂化,为直线形
D.H2S中S原子sp杂化,为直线形
难度: 简单查看答案及解析
-
有关CH2=CH-C≡N分子的说法正确的是
A.3个
键,3个π键 B.4个
键,3个2π键
C.6个
键,2个π键 D.6个
键,3个π键
难度: 简单查看答案及解析
-
基态碳原子的最外能层的各能级中,电子排布的方式正确的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
已知含氧酸可用通式(OH)nXOm来表示,如X是S,则m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m大的是强酸,m小的是弱酸。下列各含氧酸中酸性最强的是( )
A.H2SeO3 B.HMnO4 C.H3BO3 D.H3PO4
难度: 简单查看答案及解析
-
下列每组物质中化学键类型和分子的极性都相同的是( )
A.CO2和CS2 B.NaCl和HCl C.H2O和CH4 D.O2和HBr
难度: 简单查看答案及解析
-
下列物质的沸点按由高到低的顺序排列的是( )
A.HF、HCl、HBr、HI
B.F2、Cl2、Br2、I2
C.H2O、H2S、H2Se、H2Te
D.CI4、CBr4、CCl4、CF4
难度: 中等查看答案及解析
-
下图为甲烷晶体的晶胞结构,下列有关说法正确的是( )
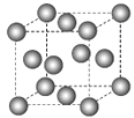
A.甲烷晶胞中的球体只代表一个碳原子
B.晶体中1个
分子有12个紧邻的甲烷分子
C.
晶体熔化时需克服共价键
D.一个甲烷晶胞中含有8个
分子
难度: 简单查看答案及解析
-
SiCl4的分子结构与CCl4相似,则下列推测不正确的是( )
A.SiCl4晶体是分子晶体 B.常温常压下SiCl4是气体
C.SiCl4分子是由极性键形成的非极性分子 D.SiCl4的熔、沸点高于CCl4
难度: 中等查看答案及解析
-
二氧化硅晶体是立体网状结构,其晶体模型如图所示。下列有关二氧化硅晶体的说法正确的是( )
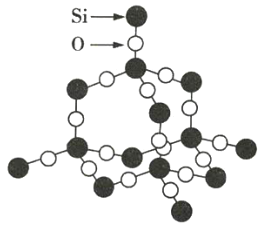
A.二氧化硅晶体最小环上含有12个原子
B.每个硅原子为4个最小环所共有
C.从晶体结构可知,1molSiO2拥有2molSi-O键
D.SiO2晶体是由极性共价键与非极性共价键共同构成的
难度: 中等查看答案及解析
-
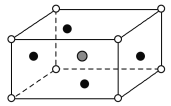
最近发现一种由某金属原子M和非金属原子N构成的气态团簇分子,如图所示.顶角和面心的原子是M原子,棱的中心和体心的原子是N原子,它的化学式为
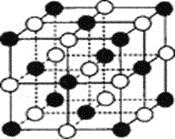
A.M4N4 B.MN C.M14N13 D.M4N5
难度: 简单查看答案及解析
-
有下列离子晶体的空间结构示意图:以M代表阳离子,以N代表阴离子,•为阳离子,。为阴离子,化学式为MN2的晶体结构为( )
A.
B.
C.
D.

难度: 简单查看答案及解析
-
BeCl2熔点较低,易升华,溶于醇和醚,其化学性质与AlCl3相似。由此可推测BeCl2
A.熔融态不导电 B.水溶液呈中性
C.熔点比BeBr2高 D.不与氢氧化钠溶液反应
难度: 简单查看答案及解析
-
在以下的分子或离子中,空间结构的几何形状不是三角锥形的是( )
A.NF3 B.CH3- C.BF3 D.H3O+
难度: 简单查看答案及解析
-
下列说法中错误的是( )
A.干冰与二氧化硅晶体熔化时,所克服的微粒间相互作用不相同
B.C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键
C.非金属单质只能形成分子晶体
D.金刚石熔化时断裂共价键
难度: 简单查看答案及解析
-
在下列三种晶体:①金刚石,②晶体硅,③碳化硅中,它们的熔点从高到低的顺序是
A. ①③② B. ②③①
C. ③①② D. ②①③
难度: 简单查看答案及解析
-
区分晶体和非晶体最可靠的科学方法是( )
A.观察外观是否规则 B.测定是否有固定的熔点
C.进行X射线衍射实验 D.验证是否有各向异性
难度: 中等查看答案及解析
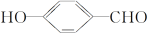 的沸点比
的沸点比