-
某物质A的实验式为CoCl3·4NH3,1molA中加入足量的AgNO3溶液中能生成1mol白色沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是
A.Co3+只与NH3形成配位键
B.配合物配位数为3
C.该配合物可能是平面正方形结构
D.此配合物可写成[Co(NH3)4 Cl2] Cl
难度: 中等查看答案及解析
-
下列各原子或离子的电子排列式错误的是( )
A.Na+ 1s22s22p6 B.F¯ 1s22s22p6
C.Fe2+ 1s22s22p6 3s23p63d44s2 D.Cu [Ar]3d104s1
难度: 简单查看答案及解析
-
下表为周期表前四周期的一部分,有关R、W、X、Y、Z五种元素的叙述正确的是( )
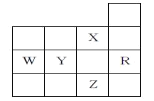
A.W元素的第一电离能小于Y元素的第一电离能
B.Y、Z的阴离子电子层结构都与R原子的相同
C.YX6是由极性键形成的非极性分子
D.p轨道未成对电子最多的是Z元素
难度: 简单查看答案及解析
-
类推法在化学学习过程中广泛使用,如下四项推测,其中正确的是( )
A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
B.根据结构和组成相似的物质,沸点随相对分子质量增大而升高,推出NH3的沸点低于PH3
C.CO2中的C采用sp杂化轨道成键,CS2中的C也是采用sp杂化轨道成键
D.CH4的空间结构为正四面体,键角为109°28′,P4的空间结构也为正四面体,键角为109°28′
难度: 简单查看答案及解析
-
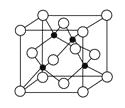
如图是NaCl晶体的一个晶胞的结构模型(黑球为Cl-、白球为Na+)。KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-的位置用O2-代替,则下列对于KO2晶体结构的描述不正确的是( )
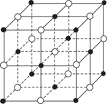
A.与K+距离相等且最近的K+有8个
B.与K+距离相等且最近的O2-构成的多面体是正八面体
C.一个KO2晶胞中的K+和O2-粒子数均为4个
D.与K+距离相等且最近的O2-共有6个
难度: 简单查看答案及解析
-
锂和镁在元素周期表中有特殊“对角线”关系,它们的性质相似。下列有关锂及其化合物叙述正确的是( )
A.Li2SO4难溶于水
B.Li与N2反应的产物是Li3N
C.LiOH易溶于水
D.LiOH与Li2CO3受热都很难分解
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.第ⅥA族元素形成的简单氢化物中,稳定性最好的其沸点也最高
B.除氢元素外最外层都只有一个电子的元素,其化学性质相似
C.根据原子核外电子排布的特点,Cu在元素周期表中位于d区
D.在周期表中,元素F的电负性最大,Li的电负性最小
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.基态原子的能量一定比激发态原子的能量低
B.某原子的电子排布式为:1s22s22p63s23p63d54s1,其表示的是基态原子的电子排布
C.日常生活中我们看到的许多可见光,如霓虹灯光、节日焰火,是因为原子核外电子发生跃迁吸收能量导致的
D.电子仅在激发态跃迁到基态时才会产生原子光谱
难度: 简单查看答案及解析
-
玻尔理论、量子力学理论及原子轨道是结构化学的重要理论,请根据这些理论来判断下列说法正确的是 ( )
A.凡中心原子采取sp3杂化轨道成键的分子,其几何构型都是正四面体
B.3px、3py、3pz的差异之处在于三者中电子(基态)的能量不同
C.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道
D.原子轨道和电子云都可用来形象地描述电子运动状态
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
A.X、W元素的离子半径 W<X
B.一定条件下,W单质可以与Z元素的氢化物发生化学反应
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,Z单质与W的常见单质直接生成ZW2
难度: 中等查看答案及解析
-
三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4O10,下列有关P4S3的说法中不正确的是( )
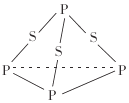
A.P4S3属于共价化合物
B.1mol P4S3分子中含有9mol共价键
C.P4S3充分燃烧的化学方程式为P4S3+8O2
P4O10+3SO2
D.P4S3中磷元素为+3价
难度: 简单查看答案及解析
-
我国前科学院院长卢嘉锡与法裔加拿大科学家 Gignere巧妙地利用尿素(H2NCONH2)和H2O2 形成加合物H2NCONH2 • H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2的结构如下图所示,结合以上信息,下列说法中正确的是 ( )
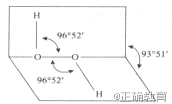
A.H2O2仅有氧化性
B.H2O2是非极性分子,其结构简式为HO—OH
C.H2NCONH2和H2O2是通过氢键结合的
D.任何分子式中的" • "都表示氢键
难度: 中等查看答案及解析
-
化学与人们的日常生活联系非常紧密,下列说法中错误的是( )
A.含氯消毒剂(如84消毒液)使用过程中有化学反应发生
B.丙三醇可以用作保湿护肤品
C.甲醛的水溶液可以用于浸泡生物标本,其中碳原子的杂化方式为sp
D.75%的酒精杀菌消毒的原理是使蛋白质变性
难度: 简单查看答案及解析
-
下列实验操作与实验目的对应的是 ( )
实验操作
实验目的
A、向淀粉水解液中直接滴加碘水
检验淀粉是否完全水解
B、C2H4 与SO2 混合气体通过盛有酸性高锰酸钾的洗气瓶
除去 C2H4 中的SO2
C、 将电石和饱和氯化钠溶液反应生成的气体通入饱和硫酸铜溶液中
验证生成的是乙炔气体
D、将溴乙烷与氢氧化钠水溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液
检验溴乙烷中的溴
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
乙酰水杨酸即阿司匹林是最常用的解热镇痛药,其结构如图所示。关于它的描述中不正确的是( )
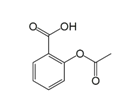
A.分子式为C9H8O4
B.其在酸性条件下水解产物遇氯化铁溶液可以呈现紫色
C.1mol 乙酰水杨酸最多可以与3molH2 反应
D.1mol 乙酰水杨酸最多可以与2molNaOH 反应
难度: 中等查看答案及解析
-
C5H11Cl 的同分异构体有几种(考虑手性异构) ( )
A.8 B.9 C.10 D.11
难度: 中等查看答案及解析
-
下列各物质互为同分异构体的是 ( )
A.乙醇和乙醚 B.2-甲基丁烷和新戊烷
C.淀粉和纤维素 D.金刚石和石墨
难度: 简单查看答案及解析
-
由氯乙烷及必要的无机试剂合成乙二醛,其依次发生的反应类型为( )
A.取代、消去、加成、还原 B.加成、消去、水解、氧化
C.消去、加成、取代、氧化 D.水解、消去、加成、取代
难度: 中等查看答案及解析