-
下列叙述正确的是 ( )
A.O2分子间存在着非极性共价键 B.CO2分子内存在着极性共价键
C.SO2与H2O反应的产物是离子化合物 D.盐酸中含有H+和Cl-,故HCl为离子化合物
难度: 简单查看答案及解析
-
X元素最高价氧化物对应的水化物为H3XO4,则它对应的气态氢化物为
A. HX B. H2X C. XH4 D. XH3
难度: 中等查看答案及解析
-
下列各组物质中化学键的类型相同的是( )
A. HCl MgCl2 NH4Cl B. H2O Na2O CO2
C. CaCl2 NaOH H2O D. NH3 H2O CO2
难度: 中等查看答案及解析
-
烷烃分子中的碳原子与其他原子的结合方式是( )
A.形成四对共用电子对 B.通过非极性键
C.通过两个共价键 D.通过离子键和共价键
难度: 简单查看答案及解析
-
元素X的原子核外M电子层有3个电子,元素Y2-离子核外共有18个电子,则这两种元素可形成的化合物为
A.XY2 B.X2Y C.X2Y3 D.X3Y2
难度: 简单查看答案及解析
-
下列说法错误的是
A.原子半径:F<Mg<K B.稳定性:PH3>H2S>NH3
C.酸性:H3PO4<H2SO4<HClO4 D.碱性:Al(OH)3<Mg(OH)2<KOH
难度: 中等查看答案及解析
-
含硒(Se)的保健品已开始进入市场。已知硒与氧同主族,与钾同周期,则下列关于硒的叙述中,正确的是
A.非金属性比硫强 B.氢化物比HBr稳定
C.原子序数为34 D.最高价氧化物的水化物显碱性
难度: 简单查看答案及解析
-
有如下两个反应,关于这两个反应的叙述错误的是( )
①2HCl
H2↑+Cl2↑ ②2HCl
H2↑+Cl2↑
A.①②两反应都是氧化还原反应
B.①②两反应中的能量转换方式都是热能转变为化学能
C.①反应是热能转变为化学能
D.②反应是电能转变为化学能
难度: 简单查看答案及解析
-
某同学做完铜、锌原电池的实验后得到下列结论,不正确的是( )
A.构成原电池正极和负极的材料必须是两种金属
B.由铜、锌电极与硫酸铜溶液组成的原电池铜是正极
C.电子沿导线由锌流向铜,在铜极上氢离子得到电子而放出氢气
D.铜锌原电池工作时,锌溶解,所以才产生电子
难度: 简单查看答案及解析
-
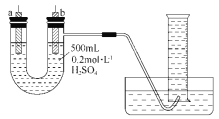
分析下面化学键键能数据,判断下列分子中受热时最不稳定的是( )
化学键
H-H
H-F
H-Br
H-I
键能(kJ/mol)
436
565
368
297
A.氢气 B.氟化氢 C.溴化氢 D.碘化氢
难度: 简单查看答案及解析
-
新的替代能源主要包括( )
①核能 ②柴草 ③煤炭 ④太阳能 ⑤氢气 ⑥液化石油气 ⑦水煤气 ⑧天然气
A.②③⑥⑦ B.①④⑤
C.③⑥⑦⑧ D.①②④
难度: 简单查看答案及解析
-
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
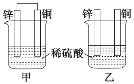
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的c(H+)均减小
D.产生气泡的速率甲比乙慢
难度: 简单查看答案及解析
-
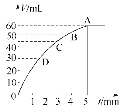
在2L密闭容器中,在一定条件下发生A(g)+3B(g)
2C(g),在10s内反应物A的浓度由1mol/L降到0.4mol/L,则ν(C)为( )。
A.0.06mol/(L·s) B.0.12mol/(L·s)
C.0.6mol/(L·s) D.1.2mol/(L·s)
难度: 简单查看答案及解析
-
下列各组物质中,互称为同分异构体的是( )。
A.水和冰 B.H2 和D2和 T2
C.
D.
难度: 简单查看答案及解析
-
乙烯可以催熟果实,为了延长果实的寿命,便于长距离运输,人们在装有果实的密闭容器内放入浸泡过某种溶液的硅藻土,用来吸收果实产生的乙烯。该溶液最可能是( )
A.NaCl溶液 B.NaOH溶液 C.溴水 D.KMnO4溶液
难度: 简单查看答案及解析
-
既可以用来鉴别甲烷和乙烯,又可以用来除去甲烷中混有的少量乙烯的操作方法是( )
A. 混合气体通过盛有酸性高锰酸钾溶液的洗气瓶
B. 混合气体通过盛有足量溴水的洗气瓶
C. 混合气体通过盛有蒸馏水的洗气瓶
D. 混合气体与适量氯化氢混合
难度: 中等查看答案及解析