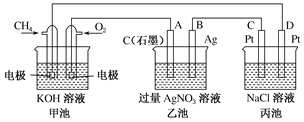
-
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2
下列有关该电池的说法正确的是
A. 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B. 电池放电时,正极反应为Fe+2OH--2e-===Fe(OH)2
C. 电池充电过程中,阴极附近溶液的pH降低
D. 电池充电时,阴极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O
难度: 中等查看答案及解析
-
化学在生产和生活中有着重要的应用,下列叙述错误的是
A. 氨态氮肥不能与草木灰混合施用
B. 利用明矾溶液的酸性可清除铜制品表面的铜锈
C. 在入海口的钢铁闸门上装一定数量的铜块儿可防止闸门被腐蚀
D. 锌具有导电性和还原性,可用作锌锰干电池的负极材料
难度: 中等查看答案及解析
-
下列有关叙述正确的是
A. 不需要加热就能发生的化学反应一定是放热反应
B. 弱电解质溶液的导电能力一定比强电解质溶液的导电能力弱
C. 水电站把机械能转化为电能,而核电站把化学能转化为电能
D. 升高温度,可提高活化分子百分数,使有效碰撞几率增大,化学反应速率加快
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A. 新制的氯水在光照条件下颜色变浅
B. 合成氨工业中使用铁触媒作催化剂
C. 红棕色的NO2气体,加压后颜色先变深后变浅
D. 工业生产硫酸的过程中,通入过量的空气以提高二氧化硫的转化率
难度: 中等查看答案及解析
-
下列实验操作能达到目的的是
①用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体 ②用加热蒸发K2CO3溶液的方法获得K2CO3晶体③用Na2S溶液和CuSO4溶液反应制取CuS固体 ④加热MgCl2溶液制取MgCl2固体
A. ①② B. ②③ C. ③④ D. ①③
难度: 中等查看答案及解析
-
常温时,下列事实一定能证明HA是弱酸的是
A.用HA溶液做导电实验,灯泡很暗
B.HA和CaCO3发生反应放出CO2
C.pH=2的HA溶液稀释至100倍,pH小于4
D.pH=3的HA溶液中水电离出的c(H+)为10-11mol·L-1
难度: 简单查看答案及解析
-
常温下,在下列溶液中可能大量共存的离子组是
A. pH=0的溶液:Fe2+、Mg2+、NO3-、SO42-
B. 由水电离出的c(H+)=1×10-13 mol/L的溶液:Al3+、K+、SO42-、Cl-
C. c (OH-)/c(H+)=1012的溶液中:Na+、SO42-、NO3-、HCO3-
D. 滴加KSCN变红色的溶液:Na+、K+、Al3+、CO32-
难度: 困难查看答案及解析
-
在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是

A. T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等
B. 向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液
由Y点变为X点
C. T ℃时,Ag2CrO4的Ksp为1×10-8
D. 图中a=
×10-4
难度: 简单查看答案及解析
-
下列说法正确的是
A. 常温下,pH=4.3的CH3NOOH和CH3COONa混合溶液中:c(Na+) > c(CH3COO-)
B. 根据Ksp (CaCO3)<Ksp (CaSO4),在生产中可用Na2CO3溶液处理锅炉水垢中的CaSO4,使之转化为疏松、易溶于酸的CaCO3
C. 常温下,将醋酸稀溶液加水稀释,醋酸电离程度增大,溶液导电能力增强
D. 已知反应:3H2(g)+WO3(s)
W(s)+3H2O(g)只有在高温时才能自发进行,则它的ΔS<0
难度: 困难查看答案及解析
-
T ℃时,某NaOH溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如表中所示:
序号
NaOH溶液的体积/mL
盐酸的体积/mL
溶液的pH
①
20.00
0.00
8
②
20.00
20.00
6
假设溶液混合前后的体积变化忽略不计,则c为
A. 3 B. 4 C. 5 D. 6
难度: 中等查看答案及解析
-
将CO2转化为甲醇的原理为 CO2(g)+3H2(g)
CH3OH(g)+H2O(g) △H<0。500℃时,在体积为1L的固定容积的密闭容器中充入lmolCO2、3molH2,测得CO2浓度与CH3OH浓度随时间的变化如图所示,下列结论错误的是( )

A. 曲线X可以表示CH3OH(g)或H2O(g)的浓度变化
B. 从反应开始到l0min时,H2的反应速率v(H2)=0.225 mol/(L·min)
C. 平衡时H2的转化率为75%
D. 500℃时该反应的平衡常数K=3
难度: 中等查看答案及解析
-
0.02 mol/L HCN溶液与0.01 mol/L NaOH溶液等体积混合,已知混合溶液c(CN-)<c(Na+),则下列关系正确的是
A. c(Na+)>c(CN-)>c(OH-)>c(H+) B. c(HCN)+c(H+)=c(OH-)
C. c (OH-)+c(CN-) =0.02mol/L D. c(CN-)>c(HCN)
难度: 困难查看答案及解析
-
今有室温下四种溶液,有关叙述不正确的是
①
②
③
④
pH
11
11
3
3
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
A. ①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B. 分别加水稀释10倍,四种溶液的pH ①>②>④>③
C. ①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
D. VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va ∶Vb= 11∶9
难度: 中等查看答案及解析
-
将0.2 mol·L-1的KI溶液和0.05 mol·L-1Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-
2Fe2++I2”的是
实验编号
实验操作
实验现象
①
滴入KSCN溶液
溶液变红色
②
滴入AgNO3溶液
有黄色沉淀生成
③
滴入K3[Fe(CN)6]溶液
有蓝色沉淀生成
④
滴入淀粉溶液
溶液变蓝色
A. ①和② B. ②和④ C. ③和④ D. ①和③
难度: 简单查看答案及解析
-
常温下,用 0.1 mol·L—1HCl溶液滴定10.0 mL浓度为0.1 mol·L—1 Na2CO3溶液,所得滴定曲线如图所示。下列说法正确的是
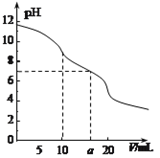
A. 当V=0时:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)
B. 当V=5时:c(CO32—)+c(HCO3-)+c(H2CO3)=c(Cl-)
C. 当V=10时:c(Na+)>c(HCO3-)>c(CO32—)>c(H2CO3)
D. 当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-)
难度: 困难查看答案及解析
-
利用反应 6NO2 + 8NH3===7N2 + 12H2O 构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是 ( )
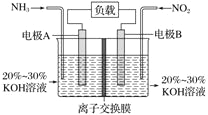
A. 电流从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极 A 极反应式为 2NH3 - 6e- ===N2 + 6H+
D. 当有 4.48 L NO2( 标准状况 ) 被处理时,转移电子为 0.8 mol
难度: 困难查看答案及解析
-
常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A. 1∶9 B. 1∶1 C. 1∶2 D. 1∶4
难度: 中等查看答案及解析
-
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:下列说法不正确的是( )

A. 在阴极室,发生的电极反应为:2H2O + 2e 2OH -+ H2↑
B. 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+ 浓度增大,使平衡2CrO42- + 2H+
Cr2O72- + H2O向右移动
C. 该制备过程中总反应的化学方程式为4K2CrO4 + 4H2O
2K2Cr2O7 + 4KOH + 2H2↑+ O2↑
D. 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr) 为d,则此时铬酸钾的转化率为(1-d/2)。
难度: 困难查看答案及解析