-
下列有关新型冠状病毒说法错误的是( )
A.构成冠状病毒的蛋白质完全水解后形成的都是α—氨基酸
B.冠状病毒在空气中可以以“气溶胶”形式进行传播
C.乙醚、95%的乙醇、“84”消毒液等可有效杀灭活病毒
D.绝大多数病毒疫苗应避光、冷藏保存
难度: 简单查看答案及解析
-
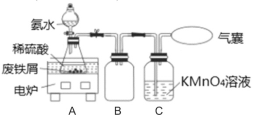
下列实验所选装置不合理的是( )
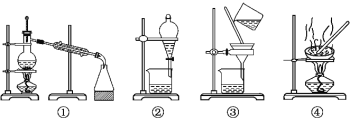
A.浓缩硝酸钾溶液,应选择装置④
B.从碘水中分离出碘单质,应选择装置②①
C.溴单质和四氯化碳的分离,应选择装置②
D.粗盐的提纯,应用到装置③④
难度: 简单查看答案及解析
-
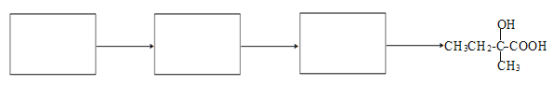
下列有关有机物的说法正确的是( )
A.分子式为C9H18O2的酯,在酸性条件下加热可水解产生相对分子质量相同的两种有机物,则符合此条件的C9H18O2的结构有18种
B.甲苯和Cl2在光照下的反应与乙醇和乙酸在浓硫酸作用下的反应属于同一类型的反应
C.lmol
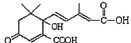 与NaOH溶液反应,最多可消耗3molNaOH
与NaOH溶液反应,最多可消耗3molNaOHD.淀粉、油脂和蛋白质都能在NaOH作用下发生水解反应
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.1mol硝基(-NO2)与46gNO2所含的电子数均为23NA
B.1mol环己烷中含有共价键数为12NA
C.向FeI2溶液中通入适量Cl2,当有1molFe2+被氧化时,转移的电子数为NA
D.电解精炼铜时,若转移了NA个电子,则阳极质量减小32g
难度: 简单查看答案及解析
-
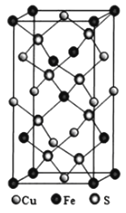
短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( )
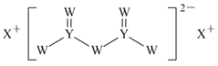
A.熔点:Y单质高于X单质
B.元素非金属性强弱的顺序为W>Y>Z
C.W的简单氢化物稳定性比Y的简单氢化物稳定性低
D.W分别与X、Y、Z形成的二元化合物均只有两种
难度: 中等查看答案及解析
-
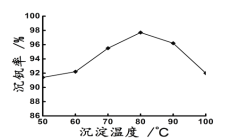
25℃时,向40mL0.05mol/L的FeCl3溶液中一次性加入10mL0.15mol/L的KSCN溶液,发生反应,混合溶液中c(Fe3+)与反应时间(t)的变化如图所示。下列说法正确的是( )
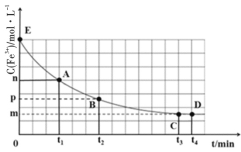
A.该反应的离子方程式为Fe3++3SCN-
Fe(SCN)3↓
B.E点对应的坐标为(0,0.05)
C.t4时向溶液中加入50mL0.1mol/LKCl溶液,平衡不移动
D.若该反应是可逆反应,在25℃时平衡常数的数值为
难度: 中等查看答案及解析
-
验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
①
②
③
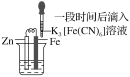


在Fe表面生成蓝色沉淀
试管内无明显变化
试管内生成蓝色沉淀
下列说法不正确的是( )
A.对比②③,可以判定Zn保护了Fe
B.将Zn换成Cu,用①的方法可判断Fe比Cu活泼
C.验证Zn保护Fe时不能用①的方法
D.对比①②,K3[Fe(CN)6]可能将Fe氧化
难度: 中等查看答案及解析