-
在乙烯分子中有5个σ键、一个π键,它们分别是( )
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C—H之间是sp2形成的σ键,C—C之间未参加杂化的2p轨道形成的是π键
D.C—C之间是sp2形成的σ键,C—H之间是未参加杂化的2p轨道形成的π键
难度: 简单查看答案及解析
-
水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是( )
A.玻璃态是水的一种特殊状态 B.水由液态变为玻璃态,体积膨胀
C.水由液态变为玻璃态,体积缩小 D.玻璃态水是分子晶体
难度: 简单查看答案及解析
-
下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )
A.SiO2和SO2 B.CO2和H2O C.NaCl和HCl D.CCl4和KCl
难度: 简单查看答案及解析
-
下列轨道表示式能表示氮原子的最低能量状态的是( )
A.
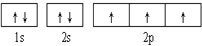
B.
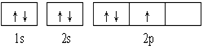
C.
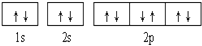
D.
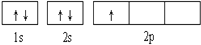
难度: 简单查看答案及解析
-
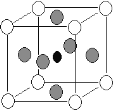
据2001年报道,由硼和镁形成的化合物刷新了金属化合物超导的最高纪录。如图示意的是该化合物的晶胞结构:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱侧面上。则该化合物的化学式为( )
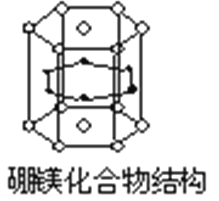
A.MgB B.Mg5B2 C.Mg2B D.Mg2B3
难度: 简单查看答案及解析
-
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.X与Y形成化合物时,X显负价,Y显正价
B.在元素周期表中,X可能位于Y的右边
C.最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性
D.Y的气态氢化物的稳定性弱于X的气态氢化物的稳定性
难度: 简单查看答案及解析
-
Rm+与Xn-具有相同的电子层结构,则两种微粒半径大小关系为( )
A.前者大于后者 B.前者小于后者 C.前者等于后者 D.不能确定
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.氢键既可能存在于分子内,又可能存在于分子间
B.邻羟基苯甲酸的熔点比对羟基苯甲酸的熔点高
C.水结冰体积膨胀,密度减小,水加热到很高温度都难以分解,这都与水分子间形成氢键有关
D.氢键比分子间作用力强,所以它属于化学键
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B.
是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C.
是极性分子,分子中O原子不在2个H原子所连线段的中点处
D.
是非极性分子,分子中C原子不在2个O原子所连线段的中点处
难度: 简单查看答案及解析
-
下列各微粒属于等电子体的是( )
A.N2O4和NO2 B.CH4和NH4+ C.CO2和NO2 D.C2H6和N2H6
难度: 简单查看答案及解析
-
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,生成深蓝色的配合离子[Cu(NH3)4]2+
C.深蓝色的透明溶液是硫酸铜溶液
D.在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道
难度: 简单查看答案及解析
-
干冰本是分子晶体,但在40GPa的高压下,用激光器加热到1800K时,人们成功制得了原子晶体干冰,下列推断正确的是
A.原子晶体干冰有很高的熔、沸点,有很大的硬度
B.原子晶体干冰易气化,可用作致冷剂
C.分子晶体干冰硬度大,可用于耐磨材料
D.每摩尔原子晶体干冰中含2molC—O键
难度: 简单查看答案及解析
-
氯化硼的熔点为-107℃,沸点为12.5℃,其分子中键与键之间的夹角为120°,它能水解,有关叙述不正确的是
A.氯化硼液态时能导电而固态时不导电
B.硼原子以sp2杂化
C.氯化硼分子呈正三角形,属非极性分子
D.氯化硼遇水蒸气会产生白雾
难度: 简单查看答案及解析
-
NCl3中,N原子采用的轨道杂化方式是
A.sp B.sp2 C.sp3 D.不确定
难度: 简单查看答案及解析
-
下列化合物中含有手性碳原子的是
A.CCl2F2 B.
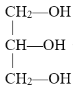 C.CH3CH2OH D.
C.CH3CH2OH D.难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列说法错误的是
A.12克金刚石中C-C键为4 NA B.12克石墨中C-C键为1.5 NA
C.124克白磷中P-P键为6 NA D.60克二氧化硅中Si-O键为4 NA
难度: 简单查看答案及解析
-
下列化合物,按其晶体的熔点由高到低排列正确的是:
A.
、
、
、
B.
、
、
、
C.
、
、
、
D.
、
、
、
难度: 简单查看答案及解析
-
下列叙述正确的是
A.CS2为V型极性分子 B.ClO3-的空间构型为平面三角形
C.SF6中有六对完全相同的成键电子对 D.SO32-的中心原子是sp2杂化
难度: 简单查看答案及解析
-
下列叙述正确的是:
A.同一主族的元素,原子半径越大,其单质的熔点一定越高
B.只要含有金属阳离子的晶体就一定是离子晶体
C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
D.稀有气体元素的原子序数越大,其单质的沸点一定越高
难度: 简单查看答案及解析
-
下列说法中正确的是
A.离子晶体中每个离子周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外加电场的作用下,金属产生了自由电子
C.分子晶体的熔沸点很低,常温下都呈液态或是气态
D.原子晶体中的各相邻原子都以共价键结合
难度: 简单查看答案及解析