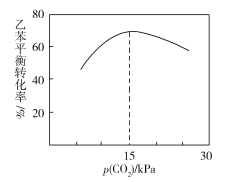
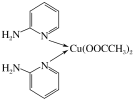
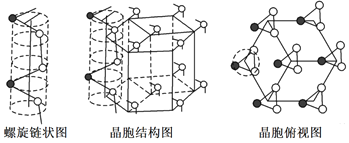
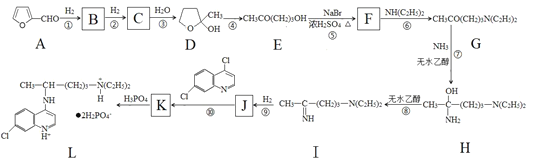
-
下列说法不正确的是( )
A.上海世博会很多场馆的外墙使用的非晶体薄膜,以充分利用太阳能,体现低碳经济
B.金属的电化学防护措施有牺牲阳极的阴极保护法和外加电流的阴极保护法
C.若在水果贮藏室中,放几块被KMnO4溶液浸透过的“砖块”,可延长水果保存时间
D.常温时,某可逆反应的平衡常数越大,则其反应速率就越快
难度: 简单查看答案及解析
-
类比推理是化学中常用的思维方法。下列推理正确的是
A.lmol晶体硅含Si-Si键的数目为2NA,则1mol金刚砂含C-Si键的数目也为2NA
B.Ca(HCO3)2溶液中加入过量的NaOH溶液,发生化学反应的方程式:
则Mg(HCO3)2溶液中加入过量的NaOH溶液,发生化学反应的方程式:
C.标准状况下,22.4 L CO2中所含的分子数目为NA个,则22.4 LCS2中所含的分子数目也为NA个
D.NaClO溶液中通人过量CO2发生了反应:
,则Ca(ClO)2溶液中通入过量CO2发生了:
难度: 中等查看答案及解析
-
LDFCB是锂离子电池的一种电解质,该电解质阴离子由同周期元素W、X、Y、Z构成(如下图),Y的最外层电子数等于X的核外电子总数,四种元素最外层电子数之和为20。下列说法正确的是( )
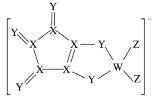
A.四种元素的单质中,Z的沸点最高
B.原子半径∶W>X>Y>Z
C.W、Z形成的分子中各原子均满足8电子稳定结构
D.Y分别与另外三种元素形成的二元化合物中,Y的价态相同
难度: 中等查看答案及解析
-
一种双室微生物燃料电池污水净化系统原理如图所示,图中酸性污水中含有的有机物用C6H12O6表示。下列有关该电池的说法不正确的是( )
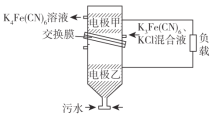
A.正极的电极反应为Fe(CN)63-+ e- =Fe(CN)64-
B.电池的总反应为C6H12O6 + 24Fe(CN)63-+6H2O=6CO2↑+Fe(CN)64-+24H+
C.该“交换膜”可选用“质子交换膜”
D.若将“K4Fe(CN)6溶液”改为“O2”,当有22.4L O2参与反应时,理论上转移4mol电子
难度: 中等查看答案及解析
-
我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
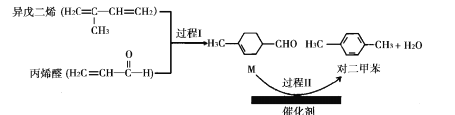
下列说法不正确的是
A.丙烯醛分子中所有原子可能共平面 B.可用溴水鉴别异戊二烯和对二甲苯
C.对二甲苯的二氯代物有6种 D.M能发生取代,加成,加聚和氧化反应
难度: 中等查看答案及解析
-
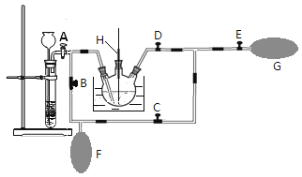
已知氨气可与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置
省略夹持装置
可以实现该反应,实验时C中粉末逐渐变为红色,D中出现无色液体。下列有关说法正确的是
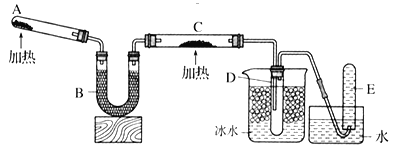
A.试管A中加入的试剂为
固体
B.反应中氧化剂和还原剂的物质的量之比为
C.装置B中加入的物质可以是碱石灰或无水氯化钙
D.装置D中液体可以使干燥的红色石蕊试纸变蓝
难度: 困难查看答案及解析
-
常温下,将盐酸滴加到联氨(N2 H4)的水溶液中,混合溶液中pOH[pOH=- lgc(OH- )]随离子浓度变化的关系如图所示。下列叙述正确的是(已知N2H4在水溶液中的电离方程式:N2H4+H2O-
N2H5++OH- ,N2H5+ +H2O-
N2H62++OH- )
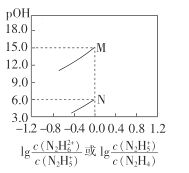
A.联氨的水溶液中不存在H+
B.曲线M表示pOH与
的变化关系
C.反应N2H4+H2O
N2H5++OH-的K=10-6
D.N2H5Cl的水溶液呈碱性
难度: 中等查看答案及解析