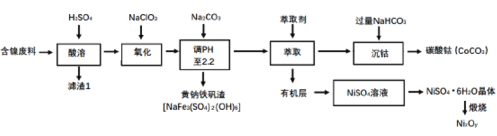
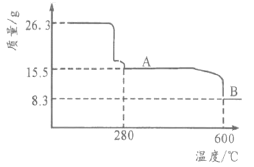
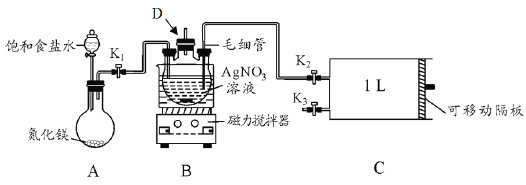
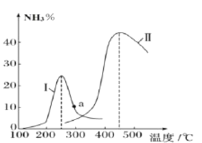
-
被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,分别为X、Y、Z、W、R、T。其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相 等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与 R原子序数之和是W的2倍。下列说法错误的是
A.离子半径:R>T>Y>Z
B.XR2、WR2两种化合物中R的化合价相同
C.最高价氧化物对应的水化物的碱性:X>Z
D.气态氢化物的稳定性:W<R<T
难度: 简单查看答案及解析
-
化学与科技、社会、生产和生活密切相关,下列说法正确的是( )
A.从海水中提取物质都必须通过化学反应才能实现
B.热的纯碱溶液可用于洗涤煤油、柴油等矿物油污
C.N95口罩用0.3微米氯化钠颗粒进行测试,阻隔率达95%以上,戴N95口罩可有效阻隔PM2.5
D.乙醚、84消毒液、过氧乙酸、90%以上乙醇等这些消毒剂均能有效对抗新型冠状病毒
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数值。下列说法正确的是( )
A.9.0g葡萄糖和蔗糖的混合物中含碳原子的数目为0.3NA
B.铅蓄电池电解NaCl溶液,得到标况下22.4L氢气,理论上铅蓄电池中消耗硫酸为2mol
C.250℃时,1LpH=2的H2C2O4溶液中含H+的数目小于0.01NA
D.1moINa2O和BaO2的混合物中含有的阴阳离子总数为3NA
难度: 中等查看答案及解析
-
工业上可用甲苯合成苯甲醛:下列说法正确的是( )
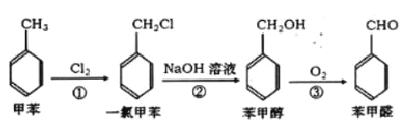
A.甲苯分子中所有原子都在同一平面内 B.反应①②③的反应类型相同
C.苯甲醇可与金属钠反应 D.一氯甲苯的同分异构体有4种
难度: 中等查看答案及解析
-
下列实验操作、现象和所得到的结论均正确的是( )
选项
实验内容
实验结论
A
取两支试管,分别加入4mL0.01mol•L-1KMnO4酸性溶液。然后向一只试管中加入0.01 mol•L-1H2C2O4溶液2mL。向另一支试管中加入0.01 mol•L-1H2C2O4溶液4mL,第一支试管中溶液褪色时间长
H2C2O4浓度越大,反应速率越快
B
室温下,用pH试纸分别测定浓度为0.1 mol•L-1HClO溶液和0.1 mol•L-1HF溶液的pH,前者pH大于后者
HClO的酸性小于HF
C
将等浓度等体积的FeCl3溶液和KI溶液混合,充分反应后滴入KSCN溶液,溶液变红
溶液中存在平衡:
2Fe3++2I-⇌2Fe2++I2
D
测量熔融状态下NaHSO4的导电性
熔融状态下NaHSO4能电离出Na+、H+、SO42-
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
现在污水治理越来越引起人们重视。可以通过膜电池除去废水中的乙酸钠和对氯苯酚(
)同时利用此装置的电能在铁上镀铜,下列说法不正确的是( )
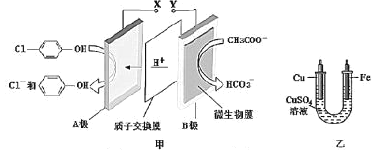
A.A极的电极反应式为
+e-=Cl-+
B.当乙中铜电极质量减少6.4g,甲中A极区增加的日的个数为0.1NA
C.膜电池不适合在较高温度环境下工作
D.反应过程中乙中电解质溶液c(Cu2+)不变
难度: 中等查看答案及解析
-
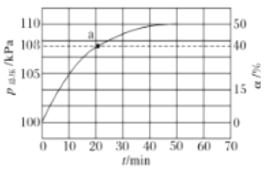
25℃时,将浓度均为0.1 mol•L-1、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。下列说法正确的是( )
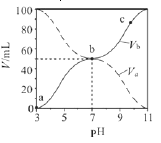
A.Ka(HA)=10-6 B.b点时,c(B+)+c(HA)=0.05mol/L
C.c点时
随温度升高而增大 D.a→c过程中水的电离程度始终增大
难度: 中等查看答案及解析