-
I.向蓝色{[Cu(H2O)4]2+}硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色{[Cu(NH3)4]2+}。
(1)H2O和NH3分子中心原子的杂化类型分别为_______、______。分子中的键角:H2O_______NH3填(“大于”或“小于’)。原因是______。
(2)通过上述实验现象可知,与Cu2+的配位能力:H2O___ NH3(填“大于”或“小于”)。
II.铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4 ( UO2(CO3)3〕等。回答下列问题:
(1)UF4用Mg或Ca还原可得金属铀。基态氟原子的价电子排布图为______;
(2)①已知:(NH4)4[UO2(CO3)3]  3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑,(NH4)4[UO2(CO3)3]存在的微粒间作用力是_____。
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑,(NH4)4[UO2(CO3)3]存在的微粒间作用力是_____。
a.离子键 b.共价键 c.配位键 d.金属键
② CO32-的空间构型______ ,写出它的等电子体的化学式(分子、离子各写一种____ 、____ 。
(3)UO2的晶胞结构如下图所示:
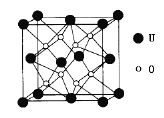
①晶胞中U原子位于面心和顶点,氧原子填充在U原子堆积形成的空隙中,在该空隙中氧原子堆积形成的立体的空间构型为_______(填“立方体”、“四面体、“八面体”);
②若两个氧原子间的最短距离为a nm,则UD2晶体的密度为______g·cm-3。(列出含a计算式即可。用NA表示阿伏加德罗常数的值。)
-
铜是人类最早发现并广泛使用的一种金属。向硫酸铜溶液中逐滴滴加稀氨水,产生蓝色沉淀:继续滴加稀氨水,沉淀溶解,溶液最终变为深蓝色:再向深蓝色溶液中加入无水乙醇,析出[Cu(NH3)4]SO4·H2O。回答下列问题:
(1)基态Cu原子中,电子在核外排布的原子轨道共有________个。
(2)N、O、S元素的原子对键合电子吸引力最大的是_________。
(3)[Cu(NH3)4]2+中,提供孤对电子的是________。Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是________(填“极性”或“非极性”)分子,由此推知[Cu(NH3)4]2+的空间构型是________。
(4)NH3中N原子的杂化方式是_________,乙醇分子中采用同样杂化方式的原子有_________________个。
(5)硫元素对应的含氧酸酸性是H2SO4强于H2SO3,其原因为_________。
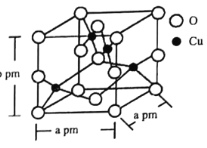
(6)铜的一种氧化物晶体结构如图所示,该氧化物的化学式是________。若该晶体结构为长方体,其参数如图,阿伏加德罗常数为NA,则该氧化物的密度为_________g·cm-3。
-
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。
(1)Cu2+基态核外电子排布式为 ;[Cu(NH3)4]SO4·H2O中,与Cu2+形成配位键的原子是 (填元素符号)。
(2)乙醇分子中O原子轨道杂化类型为 。与NH3互为等电子体的一种阳离子为 (填化学式)。
(3)N、O、S第一电离能由大到小的顺序为 。
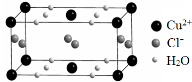
(4)某含有结晶水的铜的氯化物的晶胞结构如右图所示,该化合物的化学式是 。
-
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4•H2O。
(1)Cu2+价电子排布式为_______;[Cu(NH3)4]SO4•H2O中,1mol[Cu(NH3)4]2+含有σ键的数目为_____。
(2)SO42-中S原子轨道杂化类型为_____,H2O与H+以配位键形成H3O+,则H3O+的空间构型为____(用文字描述)。
(3)N、O、S第一电离能由大到小的顺序为___________。
(4)某含有结晶水的铜的氯化物的晶胞结构如图所示,该化合物的化学式是________。

-
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4•H2O。
(1)Cu2+基态核外电子排布式为__________;[Cu(NH3)4]SO4•H2O中,与Cu2+形成配位键的原子是_____________(填元素符号)。
(2)乙醇分子中O原子轨道杂化类型为_____________,与NH3互为等电子体的一种阳离子为_____________(填化学式).
(3)N、O、S第一电离能由大到小的顺序为_____________。
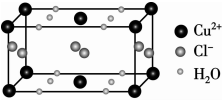
(4)某含有结晶水的铜的氯化物的晶胞结构如图所示,该化合物的化学式是_____________。
-
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。
(1)Cu2+价电子排布式为___________;[Cu(NH3)4]SO4·H2O中,1mol[Cu(NH3)4]2+含有σ键的数目为___________。
(2)SO42-中S原子轨道杂化类型为___________,H3O+几何构型为___________。
(3)NH3极易溶于H2O中,可能的原因为___________。
(4)N、O、S第一电离能由大到小的顺序为___________。

(5)Cu与F形成的化合物的晶胞结构如图所示,若晶体密度为ag·cm-3,则Cu与F最近距离为___________pm(用NA表示阿伏加德罗常数的值,列出计算表达式,不用化简)。
-
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。
(1)Cu2+价电子排布式为___________;[Cu(NH3)4]SO4·H2O中,1mol[Cu(NH3)4]2+含有σ键的数目为___________。
(2)SO42-中S原子轨道杂化类型为___________,H3O+几何构型为___________。
(3)NH3极易溶于H2O中,可能的原因为___________。
(4)N、O、S第一电离能由大到小的顺序为___________。

(5)Cu与F形成的化合物的晶胞结构如图所示,若晶体密度为ag·cm-3,则Cu与F最近距离为___________pm(用NA表示阿伏加德罗常数的值,列出计算表达式,不用化简)。
-
【化学——选修3:物质结构与性质】向硫酸铜水溶液中逐滴加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,再向溶液中加入乙醇有深蓝色晶体(化学式为[Cu(NH3)4]SO4·H2O)析出。
(1)写出上述实验前两步反应的离子方程式 , 。
(2)铜元素基态原子的电子排布式为 ,铜单质晶体中的原子堆积模型属于 堆积(填堆积模型名称)。
(3)在上述深蓝色晶体所含的非金属元素中,电负性最大的是 (填元素符号),第一电离能最大的是 (填元素符号)。该晶体中的阴离子的立体构型是 ,阴离子的中心原子的杂化方式为 。
(4)氨的沸点 (填“高于”或“低于”)膦(PH3),原因是 。
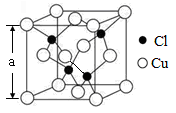
(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式是 。若该晶体的密度为ρg·cm-3,以NA表示阿伏加德罗常数,则该晶胞的边长为a= nm。
-
向硫酸铜水溶液中逐滴加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,再向溶液中加入乙醇有深蓝色晶体(化学式为[Cu(NH3)4]SO4·H2O)析出。
(1)写出上述实验前两步反应的离子方程式__________,____________。
(2)铜元素基态原子的电子排布式为_________________,铜单质晶体中的原则堆积模型属于_________堆积(填堆积模型名称)。
(3)在上述深蓝色晶体所含的非金属元素中,电负性最大的是_________(填元素符号),第一电离能最大的是_________(填元素符号)。该晶体中的阴离子的立体构型是_________,阴离子的中心原子的杂化方式为_________。
(4)氨的沸点_________(填“高于”或“低于”)膦(PH2),原因是_____________。
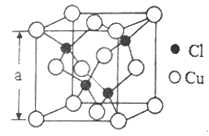
(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式是______________。若该晶体的密度为pg·cm-3,以NA表示阿伏伽德罗常数,则该晶胞的边长为a=_____________nm。
【答案】 Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- 1s22s22p63s23p63d104s1或 3d104s1 面心立方最密堆积 O N 正四面体 sp3 高于 因氨分子间存在氢键,膦分子间不存在氢键而只存在范德华力,故氨的沸点高于膦的沸点 CuCl 
【解析】(1)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-; 故答案为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(2)铜是29号元素,基态原子的电子排布式为1s22s22p63s23p63d104s1,铜单质晶体中的原子堆积模型属于面心立方最密堆积,故答案为:1s22s22p63s23p63d104s1;面心立方最密堆积;
(3)上述深蓝色晶体所含的非金属元素有N、H、O、S,其中O元素的非金属性最强,电负性最大,N的2p为半充满状态,较为稳定,第一电离能最大。[Cu(NH3)4]2+形成4个配位键,具有对称的空间构型,中心原子的杂化方式为sp3,空间结构为正四面体,故答案为:O;N;正四面体;sp3;
(4)氨分子间能够形成氢键,沸点高于膦(PH3),故答案为:高于;因氨分子间存在氢键,膦分子间不存在氢键而只存在范德华力,故氨的沸点高于膦的沸点。
(5)晶胞中Cu位于顶点、面心,晶胞中Cu原子为8× +6×
+6× =4,Cl原子位于晶胞内部,晶胞中Cl原子数目为4,故该晶体化学式为CuCl;1mol晶胞的质量为4×
=4,Cl原子位于晶胞内部,晶胞中Cl原子数目为4,故该晶体化学式为CuCl;1mol晶胞的质量为4× g,1mol晶胞的体积为a3 cm3,该晶体的密度为ρg·cm-3,因此a3 cm3×ρg·cm-3=4×
g,1mol晶胞的体积为a3 cm3,该晶体的密度为ρg·cm-3,因此a3 cm3×ρg·cm-3=4× g,解得a=
g,解得a= cm=
cm= ×107 nm,故答案为:CuCl;
×107 nm,故答案为:CuCl;  ×107。
×107。
【题型】填空题
【结束】
12
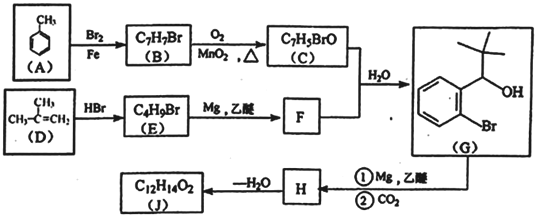
有机物J是我国自主成功研发的一类新药,它属于酯类,分子中除苯环外还含有一个五元环。合成J的一种路线如下:
已知: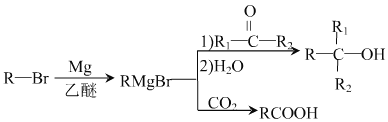
回答下列问题:
(1)A→B的反应类型为_______________。C中的官能团名称为_____________________。
(2)D生成E的化学方程式为__________________________________。
(3)J的结构简式是_____________________。在一定条件下,H 自身缩聚生成高分子化合物的化学方程式为_______________________________________。
(4) 根据C
 X,x的分子式为_____________________。X有多种同分异构体,其中满足下列条件的同分异构体共有___________种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
X,x的分子式为_____________________。X有多种同分异构体,其中满足下列条件的同分异构体共有___________种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
A.除苯环外无其他环,且无-O-O-键
B.能与FeCl3溶液发生显色反应
C.苯环上一氯代物只有两种
(5)利用题中信息和所学知识,写出以乙烯和甲苯为原料,合成 的路线流程图(其它试剂自选):__________________________________。
的路线流程图(其它试剂自选):__________________________________。
-
向硫酸铜水溶液中逐滴加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,再向溶液中加入乙醇有深蓝色晶体(化学式为[Cu(NH3)4]SO4·H2O)析出。
(1)写出上述实验前两步反应的离子方程式__________,____________。
(2)铜元素基态原子的电子排布式为_________________,铜单质晶体中的原则堆积模型属于_________堆积(填堆积模型名称)。
(3)在上述深蓝色晶体所含的非金属元素中,电负性最大的是_________(填元素符号),第一电离能最大的是_________(填元素符号)。该晶体中的阴离子的立体构型是_________,阴离子的中心原子的杂化方式为_________。
(4)氨的沸点_________(填“高于”或“低于”)膦(PH2),原因是_____________。
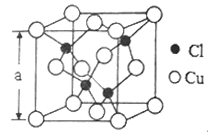
(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式是______________。若该晶体的密度为pg·cm-3,以NA表示阿伏伽德罗常数,则该晶胞的边长为a=_____________nm。
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑,(NH4)4[UO2(CO3)3]存在的微粒间作用力是_____。











