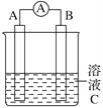
-
下列有关氮元素的单质及其化合物的说法错误的是( )
①氮气与氧气在放电的条件下可直接生成NO2 ②铵盐都不稳定,受热分解都生成氨气 ③向Fe(NO3)2溶液中滴加稀盐酸,无明显的变化 ④实验室加热氯化铵固体,用碱石灰除氯化氢的方法制备氨气
A. ①③④ B. ①③
C. ①④ D. ①②③④
难度: 中等查看答案及解析
-
如表所示有关物质检验的实验结论正确的是( )
选项
实验操作及现象
实验结论
A
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成
该溶液中一定含有SO42-
B
向某溶液中加入盐酸,将生成的气体通入品红溶液中,品红溶液褪色
该溶液一定含有SO32-
C
将某气体通入品红溶液中,品红溶液褪色
该气体一定是SO2
D
将SO2通入Na2CO3溶液中生成的气体,先通入足量的酸性KMnO4溶液,再通入澄清石灰水中有浑浊
说明酸性:H2SO3>H2CO3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
将二氧化硫通入显红色的酚酞试液中,发现红色消失,主要原因是( )
A.二氧化硫具有漂白性 B.二氧化硫具有还原性
C.二氧化硫具有氧化性 D.二氧化硫溶于水后生成酸
难度: 简单查看答案及解析
-
化学是你,化学是我,化学深入我们生活。下列说法正确的是( )
A.木材纤维和土豆淀粉遇碘水均显蓝色
B.食用花生油和鸡蛋清都能发生水解反应
C.包装用材料聚乙烯和聚氯乙烯都属于烃
D.为了身体健康,不食用任何使用食品添加剂的食物
难度: 简单查看答案及解析
-
我国具有独立知识产权的电脑芯片“龙芯一号”的问世,填补了我国计算机制造史上的一项空白。下列对硅及其化合物的有关叙述正确的是( )
A.二氧化硅既能与烧碱溶液反应又能与氢氟酸反应,所以二氧化硅是两性氧化物,
B.晶体硅的化学性质不活泼,常温下不与任何物质发生反应
C.晶体硅是一种良好的半导体材料,但是它的提炼工艺复杂,价格昂贵
D.晶体硅和金刚石的物理性质相似
难度: 简单查看答案及解析
-
下列反应中,即属于非氧化还原反应同时又是吸热反应的是( )
A.Ba(OH)2.8H2O与NH4Cl反应 B.灼热的炭与CO2反应
C.铝与稀盐酸 D.H2与O2的燃烧反应
难度: 简单查看答案及解析
-
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJ B.557 kJ
C.436 kJ D.618 kJ
难度: 简单查看答案及解析
-
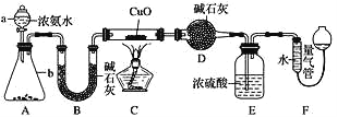
在通风橱中进行下列实验:
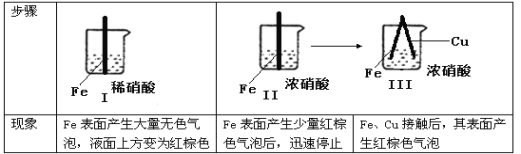
下列说法中正确的是:
A.Ⅰ中红棕色的气体的生成的化学方程式为:Fe + 6HNO 3== Fe(NO) 3+3H2O + 3NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被还原
难度: 简单查看答案及解析
-
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为 Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是 ( )
A.电池工作时,锌失去电子,发生还原反应
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
C.电池工作时,氢氧化钾电解质溶液中OH-移向负极
D.外电路中每通过0.4mol电子,锌的质量理论上减小13g
难度: 简单查看答案及解析
-
氢氧燃料电池用于航天飞船,电极反应产生的水经冷凝后可作为航天员的饮用水,其电极反应如下:
负极:2H2 + 4OH--4e-= 4H2O
正极:O2 + 2H2O + 4e-= 4OH-
当得到3.6L饮用水时,电池内转移的电子的物质的量约为( )。
A.3.6mol B.400 mol C.200 mol D.800 mol
难度: 简单查看答案及解析
-
浓硫酸与下列物质作用时,既表现氧化性,又表现酸性的是( )
①红热的木炭 ②使木材炭化 ③Cu ④FeO ⑤NH3 ⑥Fe2O3 ⑦CuSO4·5H2O ⑧对铁、铝的钝化
A.③ B.③⑧ C.③④ D.以上答案均不正确
难度: 简单查看答案及解析
-
化学反应A(g)+3B(s) ⇌2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最快的是 ( )
A.v(A)=0.25mol(L·min) B.v(B) =0.45 mol(L·s)
C.v(C)=0.45 mol(L·min) D.v(D)=0.35 mol(L·min)
难度: 简单查看答案及解析
-
可逆反应:2NO2⇌2NO+O2在恒温恒压密闭容器中反应,下列条件可判断该反应已经达到平衡状态的是( )
(1)单位时间内生成nmolO2的同时生成2nmolNO2
(2)2v正(NO2)=v逆(O2)
(3)用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的密度不再改变的状态
(6)混合气体的平均相对分子质量不再改变的状态
A.(1)(4)(6) B.(1)(2)(4)(6)
C.(1)(3)(4) D.(1)(4)(5)(6)
难度: 简单查看答案及解析
-
苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显药效的健康食品。苹果酸(2-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为
 。下列相关说法不正确的是 ( )。
。下列相关说法不正确的是 ( )。A.苹果酸能发生酯化反应的官能团有3个
B.苹果酸在一定条件下能发生催化氧化反应
C.1 mol苹果酸与足量Na反应生成33.6 L H2
D.1 mol苹果酸与NaHCO3溶液反应,最多消耗2 mol NaHCO3
难度: 简单查看答案及解析
-
使1mol乙烯与氯气完全发生加成反应,然后使该加成反应的产物与氯气在光照条件下发生取代反应,则取代反应过程中消耗氯气的总物质的量最多为( )
A.3mol B.4mol C.5mol D.6mol
难度: 简单查看答案及解析
-
下列属于物理变化的是( )
①石油的分馏 ②煤的干馏 ③石油的裂化 ④铝热反应 ⑤由乙烯制备聚乙烯
⑥将氧气转化为臭氧 ⑦乙烯催熟果实 ⑧蛋白质的盐析 ⑨海水蒸馏制取淡水
A.①②③④ B.①②⑤⑦
C.①⑧⑨ D.①②⑥⑨
难度: 简单查看答案及解析
-
绿色化学又称“环境无害化学”、“环境友好化学”、“清洁化学”,绿色化学是近十年才产生和发展起来的,是一个“新化学婴儿”。它涉及有机合成、催化、生物化学、分析化学等学科,内容广泛。绿色化学的最大特点是在始端就采用预防污染的科学手段,因而过程和终端均为零排放或零污染。世界上很多国家已把“化学的绿色化”作为新世纪化学进展的主要方向之一。以下反应最符合“绿色化学”原子经济性要求的是( )
A.异戊二烯发生加聚反应制得聚异戊二烯高分子材料
B.铝热反应冶炼铁
C.用苯和液溴为原料制取溴苯
D.双氧水分解制备氧气
难度: 简单查看答案及解析
-
为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式:2NO2+2NaOH=NaNO3+NaNO2+H2O;NO2+NO+2NaOH=2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为( )
A.
mol·L-1 B.
mol·L-1
C.
mol·L-1 D.
mol·L-1
难度: 简单查看答案及解析
-
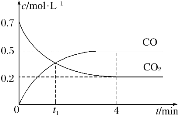
将100 mL稀硝酸和稀硫酸的混合酸溶液平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g铜粉(假设此时硝酸只被还原为NO,下同);向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示。则下列判断中错误的是

A.OA段产生的气体是NO,BC段产生的气体是H2
B.A点对应消耗NO3-物质的量为0.2 mol
C.B点对应消耗铁粉的质量为8.4 g
D.原混合酸溶液中H2SO4的浓度为4.0 mol·L-1
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.pH在5.6~7.0之间的雨水通常称为酸雨
B.新制氯水经光照一段时间后pH增大
C.燃煤时加入适量石灰石,可减少废气中SO2的量
D.大气中SO2的主要来源是汽车排出的尾气
难度: 简单查看答案及解析
-
下列有关说法不正确的是( )
A.实验室不可用中性干燥剂CaCl2干燥氨气
B.实验室可用NaOH溶液处理NO2和HCl废气
C.实验室用氯化铵溶液和氢氧化钙溶液混合制取氨气
D.实验室利用废铜屑制取CuSO4溶液的理想方法是:将废铜屑在空气中灼烧后再溶于稀硫酸
难度: 简单查看答案及解析
-
“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
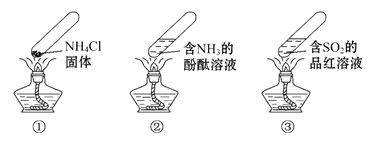
A.加热时,①中上部汇集了NH4Cl固体
B.加热时,②中溶液变红,冷却后又都变为无色
C.加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D.三个“封管实验”中所发生的化学反应都是可逆反应
难度: 中等查看答案及解析
-
提纯下列物质(括号中为少量杂质),选择的试剂和分离方法都正确的是( )。
被提纯的物质
除杂试剂
分离方法
A
甲烷(乙烯)
酸性高锰酸钾溶液
洗气
B
乙醇(碘)
氢氧化钠溶液
过滤
C
乙酸乙酯(乙醇)
饱和碳酸钠溶液
蒸馏
D
乙醇(水)
生石灰
蒸馏
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
14 g铜、银合金与一定量某浓度的硝酸溶液完全反应,将放出的气体与1.12 L(标准状况)氧气混合通入水中,恰好全部被水吸收,则合金中铜的质量是 ( )
A.9.6 g B.6.4 g C.3.2 g D.4.8 g
难度: 中等查看答案及解析