-
化学与生产、生活密切相关,下列说法不正确的是( )
A.用乙醚从青蒿中提取青蒿素,该过程包括萃取操作
B.葡萄酒中通常添加少量SO2,既可以杀菌,又可防止营养成分被氧化
C.《本草经集注》有记载:“以火烧之、紫青烟起,乃真硝石也”,区分硝石(KNO3)和朴硝(Na2SO4),该方法利用了焰色反应
D.46TiO、48TiO、50TiO互为同位素
难度: 简单查看答案及解析
-
下列关于有机化合物的说法正确的是( )
A.甲烷、苯、乙醇和乙酸均不能使酸性高锰酸钾溶液褪色
B.C4H8Cl2有11种同分异构体(不含立体异构)
C.石油经裂化和裂解可以得到乙烯、丙烯、甲烷等重要化工基本原料
D.糖类、油脂和蛋白质都能发生水解反应
难度: 中等查看答案及解析
-
以下说法正确的是( )
A.密闭容器中2 mol SO2和1 mol O2混合,在以V2O5为催化剂的条件下加热反应后,容器内物质分子数大于2NA
B.标准状况下,22.4 LSO3所含分子数为NA
C.1 L浓度为0.5 mol/L的CH3COOH溶液,含有CH3COO-数目为0.5NA
D.1 mol O2中含有1.204×1024个氧原子,占有体积22.4 L
难度: 中等查看答案及解析
-
下列不能说明氯的非金属性比硫强的事实是( )
①HClO4酸性比H2SO4强
②HCl比H2S稳定
③HCl和H2S的水溶液,前者的酸性强
④Cl2能与H2S反应生成S
⑤Cl原子能得1个电子变成稳定离子而S原子能得2个电子
A.③⑤ B.①⑤ C.②④ D.①③⑤
难度: 中等查看答案及解析
-
如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )
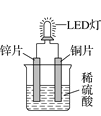
A.铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B.其能量转化的形式主要是“化学能→电能→光能”
C.如果将锌片换成铁片,电路中的电流方向将改变
D.如果将稀硫酸换成柠檬汁,LED灯将不会发光
难度: 简单查看答案及解析
-
含有下列各组离子的溶液中,后各离子仍能大量存在的是( )
选项
溶液中的离子
通入(或加入)过量的某种物质
A
H+、Ba2+、Fe3+、NO3-
通入SO2气体
B
AlO2-、Na+、Br-、SO42-
通入CO2气体
C
HCO3-、Na+、I-、HS-
通入FeCl3溶液
D
Ca2+、Cl-、K+、H+
通入CO2气体
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
在一定温度下,反应:2A(s)+2B(g)
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是( )
A.混和气体的平均相对分子质量不再改变
B.混和气体的密度不随时间而变化
C.容器内的压强不随时间而变化
D.A的质量不再变化
难度: 中等查看答案及解析
-
使反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)在2L的密闭容器中进行,半分钟后N2的物质的量增加了0.6mol。此反应的平均速率v(X)为
A.v(NH3)=0.02mol·L-1·s-1
B.v(O2)=0.01mol·L-1·s-1
C.v(N2)=0.02mol·L-1·s-1
D.v(H2O)=0.02mol·L-1·s-1
难度: 中等查看答案及解析
-
下列热化学方程式书写正确的是( )
A.2SO2+O2=2SO3 ΔH=-196.6kJ·mol-1
B.H2(g)+
O2(g)=H2O(l) ΔH=-285.8kJ
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
D.C(s)+O2(g)=CO2(g) ΔH=393.5kJ·mol-1
难度: 简单查看答案及解析
-
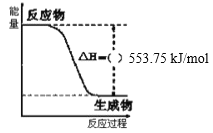
俄罗斯用“质子—M”号运载火箭成功将“光线”号卫星送入预定轨道,发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
(1)H2(g)=H2(l) △H2=-0.92 kJ/mol
(2)O2(g)=O2(l) △H2=-6.84 kJ/mol
(3)如图:下列说法正确的是( )
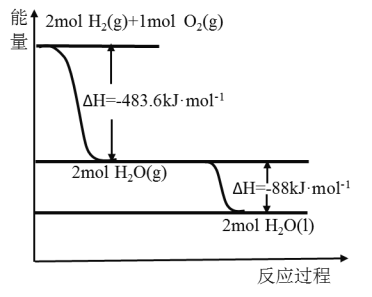
A.火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)=2H2O(g) △H=-474.92 kJ/mol
B.氢气的燃烧热为△H=-241.8 kJ/mol
C.2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
D.H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量
难度: 中等查看答案及解析
-
下列有关反应限度的叙述正确的是( )
A.使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度
B.2C(s)+O2(g)=2CO(g) △H=-2a kJ/mol,C的燃烧热为a kJ/mol
C.常温下,反应2A(s)+B(g)=2C(g)+D(g)不能自发进行,则该反应△H一定大于0
D.依据焓判据:NH4HCO3受热分解可自发进行
难度: 中等查看答案及解析
-
对室温下浓度、体积均相同的HCl溶液和CH3COOH溶液分别采取以下措施不正确的是( )
A.加足量的Zn充分反应时,在HCl溶液中的起始速率较快
B.加足量的Zn充分反应后,两溶液中产生的氢气一样多
C.使温度升高20℃,两溶液的氢离子浓度都不变
D.与等浓度的NaOH溶液反应,消耗NaOH溶液的体积一样多
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大
B. 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C. 活化分子间所发生的碰撞为有效碰撞
D. 升高温度能使化学反应速率增大的主要原因是增加了反应物中活化分子的百分数
难度: 困难查看答案及解析
-
为了探究FeCl3溶液和KI溶液的反应是否存在一定的限度,取5 mL 0.5 mol•L-1 KI溶液,滴加0.1 mol•L-1 FeCl3溶液5~6滴,充分反应。下列实验操作能验证该反应是否存在限度的是
A. 再加入CCl4振荡后,观察下层液体颜色是否变为紫红色
B. 再滴加AgNO3溶液,观察是否有黄色沉淀产生
C. 再加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察溶液是否变血红色
D. 再加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察有否白色沉淀产生
难度: 困难查看答案及解析
-
已知某可逆反应mA(g)+nB(g)
pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
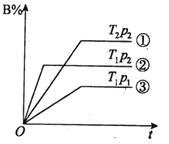
A.T1>T2 P1<P2 m+n<p 吸热反应
B.T1<T2 P1<P2 m+n>p 放热反应
C.T1<T2 P1>P2 m+n>p 放热反应
D.T1>T2 P1<P2 m+n>p 吸热反应
难度: 中等查看答案及解析