-
氢气、碳氧化物是合成可再生能源甲醇的基础原料,具有重要的应用前景。
(1)已知H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8 kJ/mol、283.0 kJ/mol和890.0 kJ/mol。一定条件下,CO与H2合成燃烧的热化学方程式为:CO(g)+3H2(g)=CH4(g)+H2O(l) △H,则△H=___;该反应能自发进行的原因是___。
(2)工业上一般采用下列两种反应合成甲醇:
反应A:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
反应B:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
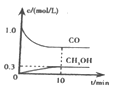
①一定温度下,在体积可变的恒压密闭容器中加入4 mol H2和一定量的CO发生反应A,开始时容器体积为2 L,CO和CH3OH(g)的浓度随时间变化如图1所示,10 min时达到平衡,则反应A的化学平衡常数为_______。(结果保留一位小数)。
②恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,下列描述能说明反应B已经达到平衡状态的是___(填序号)。
A. 容器内CO2的体积分数不再变化
B. 当CO2和H2转化率的比值不再变化
C. 当水分子中断裂2NA个O-H键,同时氢分子中断裂3NA个H-H健
D. 容器内混合气体的平均相对分子质量达到34.5,且保持不变
-
I.甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+H2(g) CO(g)+H2O(g) △H2 =41 kJ·mol-1 回答下列问题:
CO(g)+H2O(g) △H2 =41 kJ·mol-1 回答下列问题:
| 化学键 | H-H | C-O | C O O | H-O | C-H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
①已知反应①中的相关的化学键键能(“C O”表示CO的化学键)数据见表:由此计算△H1=________ kJ·mol-1
O”表示CO的化学键)数据见表:由此计算△H1=________ kJ·mol-1
②请写出CO2(g)和H2(g)反应生成CH3OH(g)和H2O(g)的热化学方程式:____________________该反应的平衡常数K3=_______________ 。 (反应①和反应②对应的平衡常数为K1和K2)
(2)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。该电池负极的电极反应式为________________。
Ⅱ.在2L密闭容器中,800℃时反应2NO(g)+O2 (g) 2NO2 (g)体系中,n(NO)随时间的变化如表:
2NO2 (g)体系中,n(NO)随时间的变化如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(3)如图所示表示NO2变化曲线的是____,用O2表示从0~2 s内该反应的平均速率v=_____。
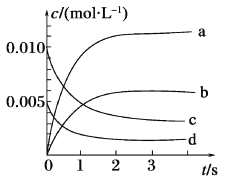
(4)能说明该反应已达到平衡状态的是_______(填序号)。
a.v(NO2) =2V(O2) b.容器内压强保持不变
c.体系颜色不再改变 d.容器内密度保持不变
-
甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。有人模拟用CO和H2合成甲醇,其反应为:CO(g) + 2H2(g) ⇌ CH3OH(g) △H<0
(1)在容积固定为1L的密闭容器内充入2 mol CO和4 mol H2发生上述反应,20min时用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
则反应从开始到20min时,以CO浓度变化表示的平均反应速率v(CO)=_________mol/(L·min),该温度下平衡常数K=___________,若平衡后增大压强,则K值_________(填“增大”、“减小”或“不变”)。
(2)在恒温恒容的密闭容器中,不能判定CO(g)+2H2(g) ⇌CH3OH(g) △H<0,反应达到平衡的是___________;
A、压强保持不变 B、气体的密度保持不变
C、气体平均摩尔质量保持不变 D、速率v(H2):v(CH3OH)=2:1
(3)如图是甲醇燃料电池结构示意图,C是________(填“正”或“负”)极,写出此电极的电极反应式__________________________________________。
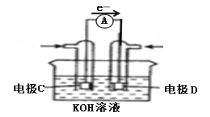
(4)若以该电池为电源,用石墨做电极电解100mL CuSO4溶液,电解一段时间后,两极均收集到11.2L的气体(标准状况下),则原CuSO4溶液的物质的量浓度为________mol/L。
-
甲醇是重要的化工原料,又是可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ⋅mol−1,2H2(g)+O2(g)═2H2O(g)△H=−484kJ⋅mol−1,工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式______________。
(2)工业上在恒容密闭容器中可采用下列反应合成甲醇CO(g)+2H2(g) CH3OH(g)ΔH
CH3OH(g)ΔH
①能判断该反应达到平衡状态的依据是_________(填母序号)。
A.2 ν逆(H 2) = ν 正(CO)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H 2的浓度都不再发生变化
E.容器内CO、H 2、CH3OH的浓度之比为1:2:1
F.CO、H2、CH3OH的速率之比为1:2:1
②CO在不同温度下的平衡转化率与压强的关系如图,该反应△H_______0(填“>”或“<”)。
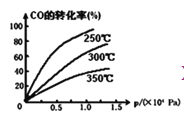
③一定温度下,将4a mol H 2和2a mol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为_______________。
-
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下方法来合成甲醇:
(1)用CO2生产甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l) △H=﹣akJ•mol﹣1;
2H2(g)+O2(g)═2H2O(l) △H=﹣b kJ•mol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:____________________。
(2)用CO生产甲醇。
已知:CO(g)+2H2(g)  CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH__________0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2 (填 “>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是______________。
A.升高温度 B. 将CH3OH(g)从体系中分离
C.使用合适的催化剂 D. 充入He,使体系总压强增大
(3)甲醇(CH3OH)可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是________________________,正极发生的电极反应式是_______________________。
-
甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔 前景。
前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ⋅mol−1,
2H2(g)+O2(g)═2H2O(g) △H=−484kJ⋅mol−1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________________________________________________________________
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g) CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
①A,B两点对应的压强大小关系是PA________PB(填“>,<,=”)
②下列叙述能说明上述反应能达到化学平衡状态的是___________(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.气体的平均相对分子质量和压强不再改变
③在P1压强、T1°C时,该反应的平衡常数K=_________(填计算结果)
④T1°C、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol, H2 :0.2mol, CH3OH:0.2mol。此时v正 ________ v逆(填> 、 < 或 =)。
-
甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔 前景。
前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ⋅mol−1,
2H2(g)+O2(g)═2H2O(g) △H=−484kJ⋅mol−1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________________________________________________________________
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g) CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
①A,B两点对应的压强大小关系是PA________PB(填“>,<,=”)
②下列叙述能说明上述反应能达到化学平衡状态的是___________(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.气体的平均相对分子质量和压强不再改变
③在P1压强、T1°C时,该反应的平衡常数K=_________(填计算结果)
④T1°C、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol, H2 :0.2mol, CH3OH:0.2mol。此时v正 ________ v逆(填> 、 < 或 =)。
-
甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔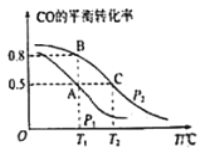 前景。
前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ⋅mol−1,
2H2(g)+O2(g)═2H2O(g) △H=−484kJ⋅mol−1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________________________________________________________________
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g) CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
①A,B两点对应的压强大小关系是PA________PB(填“>,<,=”)
②下列叙述能说明上述反应能达到化学平衡状态的是___________(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.气体的平均相对分子质量和压强不再改变
③在P1压强、T1°C时,该反应的平衡常数K=_________(填计算结果)
④T1°C、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol, H2 :0.2mol, CH3OH:0.2mol。此时v正 ________ v逆(填> 、 < 或 =)。
-
甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g)△H=+84kJ⋅mol−1
2H2(g)+O2(g)═2H2O(g)△H=−484kJ⋅mol−1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式: ________________________________
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g)⇌CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。

①A,B两点对应的压强大小关系是PA________PB(填“>,<,=”)
②A,B,C三点的平衡常数KA,KB,KC的大小关系是 __________________
③下列叙述能说明上述反应能达到化学平衡状态的是___(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
(3)在P1压强、T1°C时,该反应的平衡常数K=_________,再加入1.0molCO后重新到达平衡,则CO的转化率___________(填“增大,不变或减小”),CH3OH的体积分数_________(填“增大,不变或减小”)
(4)T1°C、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol H2 :0.2mol CH3OH:0.2mol。
此时v正 ________ v逆(填> 、 < 或 =)。
-
甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g)△H=+84kJ⋅mol−1
2H2(g)+O2(g)═2H2O(g)△H=−484kJ⋅mol−1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式: ________________________________
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g)⇌CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
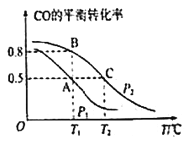
①A,B两点对应的压强大小关系是PA________PB(填“>,<,=”)
②A,B,C三点的平衡常数KA,KB,KC的大小关系是 __________________
③下列叙述能说明上述反应能达到化学平衡状态的是___(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
(3)在P1压强、T1°C时,该反应的平衡常数K=_________,再加入1.0molCO后重新到达平衡,则CO的转化率___________(填“增大,不变或减小”),CH3OH的体积分数_________(填“增大,不变或减小”)
(4)T1°C、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol H2 :0.2mol CH3OH:0.2mol。
此时v正 ________ v逆(填> 、 < 或 =)。
CH3OH(g)
CH3OH(g)+H2O(g)




 前景。
前景。 前景。
前景。 前景。
前景。
