-
化学与生活、生产、环境密切相关。下列说法错误的是( )
A.侯德榜制碱法制备NaHCO3的原理是利用溶解度较大的物质制备溶解度较小的物质
B.“雷雨肥庄稼”含义是N2最终转化成NO3-,此转化过程中氮元素被还原
C.“金柔锡柔,合两柔则为刚”中“金”为铜,说明合金的硬度一般大于各组分金属
D.我国科学家利用蜡虫肠道菌群将塑料降解的时间由500年缩减到24小时,有助于解决“白色污染”问题
难度: 中等查看答案及解析
-
实验室用SO2还原MnO2制备MnSO4的装置如图所示,下列说法正确的是( )
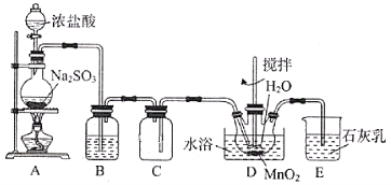
A.装置B中试剂可为Na2SO3溶液,其作用是除去SO2中的HCl
B.装置D中水浴温度应控制在80℃左右,温度过高时反应速率可能减慢
C.将装置D中所得MnSO4溶液蒸干可获得纯净的MnSO4·H2O
D.装置E中发生反应的离子方程式为SO2+2OH-=SO32-+H2O
难度: 简单查看答案及解析
-
旋烷是一类比较特殊的碳氢化合物,其张力较大。如下给出了几种旋烷的结构。下列说法不正确的是( )
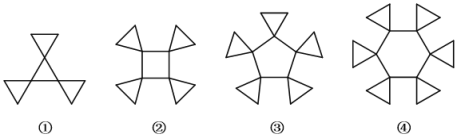
A.旋烷①与三甲苯互为同分异构体
B.旋烷②的二氯代物种类数小于其十四氯代物的种类数
C.1 mol旋烷③完全燃烧时消耗20 mol O2,生成10 mol H2O
D.旋烷系列分子中含碳量为0. 9
难度: 中等查看答案及解析
-
2019年被联合国定为“国际化学元素周期表年”,如图为元素周期表的一部分,其中W、X、Y、Z均为短周期元素,Y的氧化物易形成酸雨。下列叙述正确的是( )
W
X
Y
Z
A.X的简单氢化物为强酸
B.Z的氧化物对应水化物的酸性强于Y的氧化物对应水化物的酸性
C.WY2分子中每个原子最外层均达到8电子稳定结构
D.X单质能够从Z的盐溶液中置换出Z单质
难度: 中等查看答案及解析
-
下列实验方案与现象正确且能达到相应实验目的的是( )
选项
实验目的
实验方案与现象
A
证明新制氯水具有酸性
向新制氯水中滴加紫色石蕊试液,溶液变为红色且颜色保持不变
B
证明酸性条件下,氧化性:H2O2 > Fe3 +
向Fe(NO3)2溶液中滴加用硫酸酸化的H2O2溶液,溶液变黄色
C
证明同温下,溶度积常数:
Ksp(AgCl)> Ksp(Ag2CrO4)
向体积为100 mL、浓度均为0.01 mol·L-1的NaCl和Na2CrO4混合溶液中滴加 0.01 mol·L-1AgNO3溶液,先产生白色沉淀,后产生砖红色沉淀Ag2CrO4
D
证明溶液X中含有
向溶液X中先滴加盐酸无明显现象,再滴加BaCl2溶液,出现白色沉淀
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
我国成功研发一种新型铝-石墨双离子电池,这种新型电池采用石墨、铝锂合金作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。电池总反应为Cx(PF6) +LiAl
xC + PF6-+Li+ +Al。该电池放电时的工作原理如图所示。下列说法不正确的是( )
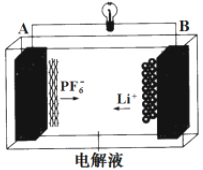
A.放电时,B极的电极反应为LiAl-e-=Li+ +Al
B.Li2SO4溶液可作该电池的电解质溶液
C.充电时A极的电极反应式为xC + PF6--e-=Cx(PF6)
D.该电池放电时,若电路中通过0.01 mol电子,B电极减重0.07 g
难度: 中等查看答案及解析
-
室温下,向100mL饱和的H2S溶液中通入SO2气体(气体体积换算成标准状况),发生反应:2H2S+SO2=3S↓+2H2O,测得溶液pH与通入SO2的关系如图所示。下列有关说法正确的是
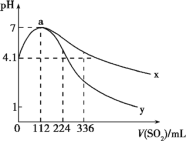
A.整个过程中,水的电离程度逐渐增大
B.该温度下H2S的Ka1数量级为10-7
C.曲线y代表继续通入SO2气体后溶液pH的变化
D.a点之后,随SO2气体的通入,
的值始终减小
难度: 中等查看答案及解析
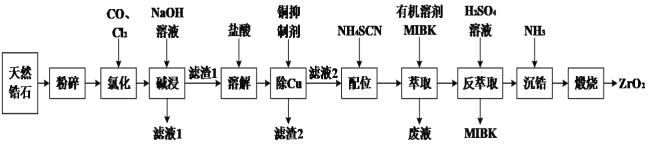
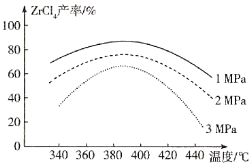
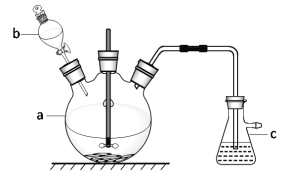
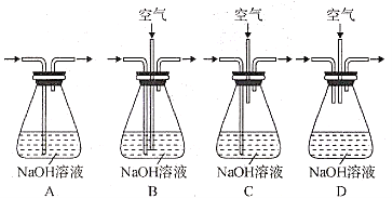
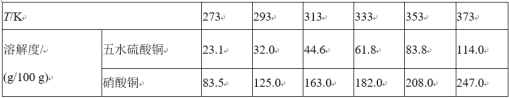
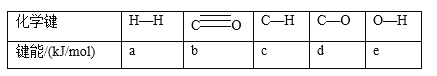
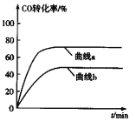
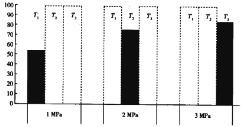
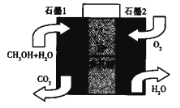

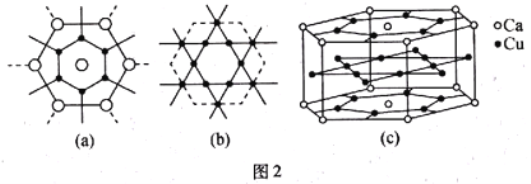
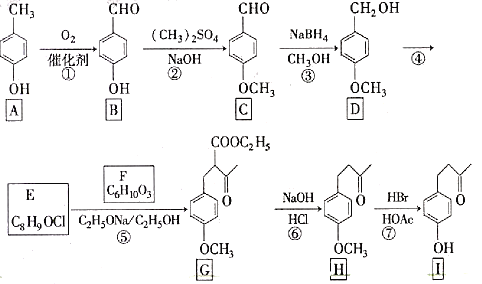
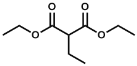 的合成路线:______(无机试剂任选)。
的合成路线:______(无机试剂任选)。