-
根据下列反应:(1)2Fe3++2I-=2Fe2++I2;(2)Br2+2Fe2+=2Br-+2Fe3+,判断离子的还原性由强到弱的顺序是( )
A.Br->I->Fe2+ B.I->Fe2+>Br-
C.Fe2+>I->Br- D.Br->Fe2+>I-
难度: 简单查看答案及解析
-
某溶液中大量存在以下浓度的五种离子:0.4mol/L Cl﹣、0.8mol/L SO42﹣、0.2mol/L Al3+、0.6mol/L H+、M,则M及其物质的量浓度可能为( )
A.Na+0.6mol/L B.CO32﹣0.2 mol/L
C.Mg2+0.4 mol/L D.Ba2+0.4mol/L
难度: 简单查看答案及解析
-
下列有关物质的分类正确的是
A.混合物:空气、矿泉水、水银
B.酸性氧化物:、CO2、SO2、CO
C.盐:醋酸钠、氯化铵、纯碱
D.弱电解质:CH3COOH、H2O、NH3
难度: 简单查看答案及解析
-
进行化学实验必须注意安全,下列说法正确的是( )
A.不慎将浓硫酸溶液沾到皮肤上,要立即涂上大量浓碱溶液将其中和
B.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛
C.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下加入浓硫酸
D.酒精灯着火时可用水扑灭
难度: 简单查看答案及解析
-
下列化学药品与其危险化学品图形标志不一致的一组是( )
A.硫磺
 B.高锰酸钾
B.高锰酸钾
C.氢气
 D.乙醇
D.乙醇
难度: 简单查看答案及解析
-
下列实验操作正确的是( )
A.
 B.
B.
C.
 D.
D.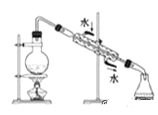
难度: 中等查看答案及解析
-
当光束通过下列分散系时,能观察到丁达尔效应的是
A.蒸馏水 B.盐酸 C.NaCl 溶液 D.Fe (OH)3 胶体
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.溶液、胶体和浊液的本质区别在于分散质粒子的直径不同
B.CO2溶于水形成的溶液能导电,所以CO2是电解质
C.溶于水后能电离出氢离子的化合物都是酸
D.氧化还原反应的本质是化合价发生升降
难度: 简单查看答案及解析
-
下列反应中,属于氧化还原反应的是( )
A.2H2O2
2H2O+O2↑
B.CuCl2+2NaOH=Cu(OH)2↓+2NaCl
C.FeO+2HCl=FeCl2+H2O
D.2Al(OH)3
Al2O3+3H2O
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.摩尔是七个基本物理量之一
B.1 mol任何物质都含有6.02×1023个分子
C.标准状况下,1 mol任何物质体积均为22.4 L
D.摩尔质量在数值上等于该物质的相对分子质量或相对原子质量
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.将1L2mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA
C.常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA个
D.标准状况下,11.2LCCl4含有的分子数为0.5NA
难度: 中等查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、CO32-、Cl-
C.碳酸氢钠溶液中:K+、SO42-、Cl-、H+
D.pH>7的溶液:K+、Ba2+、Cl-、NO3-
难度: 中等查看答案及解析
-
下列化学反应的离子方程式书写不正确的是( )
A.碳酸钙与盐酸的反应:CaCO3+2H+=Ca2++CO2↑+H2O
B.Ba(OH)2溶液与CuSO4溶液反应:Ba2++SO42-=BaSO4↓
C.氧化铜与稀H2SO4反应:CuO+2H+=Cu2++H2O
D.金属钠跟水反应:2Na+2H2O=2Na++2OH-+H2↑
难度: 简单查看答案及解析
-
下列实验中,所采用的分离或提纯与对应原理都正确的是( )
选项
目的
分离方法
原理
A
分离溶于水中的碘
乙醇萃取
碘在乙醇中的溶解度较大
B
分离氯化钠和碘的固体混合物
加热法
碘单质易升华
C
除去KNO3固体中混杂的NaCl
重结晶
NaCl在水中的溶解度很大
D
除去NaOH溶液中的Na2SO4
加适量的BaCl2后过滤
BaSO4难溶
A.A B.B C.C D.D
难度: 中等查看答案及解析