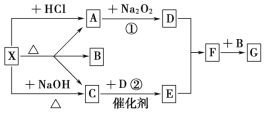
-
对溶液中的离子进行鉴定,下列实验所得结论不合理的是( )
A.溶液中加入稀硝酸后,再加入AgNO3溶液,有白色溶液生成,则溶液中可能含有Cl-
B.溶液中加入KSCN溶液,无红色出现,继续加入氯水,溶液变红色,说明溶液中事实上含有Fe2+
C.溶液中加入NaOH溶液,加热后产生使湿润的红色石蕊试纸变蓝的气体,则可能推测该溶液中含有NH4+
D.向溶液中加入盐酸,有使澄清石灰水变浑浊的无色无味的气体放出,可推测溶液中含有CO32-
难度: 中等查看答案及解析
-
从降低成本和减少环境污染的角度考虑,制取硝酸铜最好的方法是 ( )
A. 铜和浓硝酸反应 B. 氧化铜和硝酸反应
C. 铜和稀硝酸反应 D. 氯化铜和硝酸银反应
难度: 中等查看答案及解析
-
下列说法正确的是
A.向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强
B.SO2、H2S为含硫化合物,都可用浓硫酸干燥
C.将SO2通入品红溶液,溶液褪色后加热恢复原色
D.蔗糖遇浓H2SO4后变黑,膨胀,最后产生刺激性气味气体,说明浓H2SO4具有酸性、氧化性和脱水性
难度: 中等查看答案及解析
-
化学与环境密切相关,下列有关说法正确的是
A.CO2属于大气污染物 B.CO2、NO2或SO2都会导致酸雨的形成
C.酸雨是pH小于7的雨水 D.大气中CO2含量的增加会导致温室效应加剧
难度: 简单查看答案及解析
-
如图是元素周期表的一部分,已知两块阴影中间的3列属于同一族。有关阴影部分的元素,下列说法正确的是( )

A.都是主族元素 B.都是副族元素
C.有5种副族元素和2种主族元素 D.有5种主族元素和2种副族元素
难度: 简单查看答案及解析
-
化学点亮生活。下列说法中,不正确的是
A. 沙子是基本的建筑材料 B. 光导纤维的主要成分是硅
C. 硅酸钠是制备木材防火剂的原料 D. 目前制作太阳能电池板的材料是硅
难度: 中等查看答案及解析
-
下列叙述不正确的是
A.NH3易液化,液氨常用作制冷剂
B.浓硝酸不稳定,实验室保存在棕色试剂瓶中
C.铵盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处
D.N2是空气中的主要成分之一,雷雨时可直接转化为NO2
难度: 简单查看答案及解析
-
下列叙述中,正确的是
A.所有的硅酸盐都难溶于水,可用带玻璃塞的玻璃瓶盛放
B.SiO2和CO2都是酸性氧化物,既能与水反应,又能与NaOH溶液反应
C.SiO2与纯碱在高温条件下反应生成CO2,说明硅酸的酸性比碳酸强
D.石灰石是工业制备普通玻璃和水泥的共同原料
难度: 简单查看答案及解析
-
元素周期表和律可以指导人们进行规律性的推测和判断。下列说法不合理的是
A.短周期元素正化合价数值和其族序数相同
B.人们可以在周期表的过渡元素中寻找催化剂和耐腐蚀、耐高温的合金材料
C.由水溶液的酸性:HCl>HF,不能推断出元素的非金属性:Cl>F
D.短周期元素形成的微粒X2-和Y2+核外电子排布相同,离子半径:X2->Y2+
难度: 简单查看答案及解析
-
下列关于氯及其化合物的叙述正确的是
A.氯气的性质很活泼,它与氢气混合后立即发生爆炸
B.氯气是一种黄绿色、有毒的气体,闻氯气时不能将集气瓶放在鼻孔下直接闻
C.实验室制取氯气时,为了防止环境污染,多余的氯气可以用饱和食盐水吸收
D.工业上用Cl2和石灰水为原料制造漂白粉,漂白粉的有效成分是CaCl2和Ca(ClO)2
难度: 简单查看答案及解析
-
下列关于氯水的说法正确的
A.新制氯水呈浅黄绿色,是因为氯水中含有HClO
B.新制氯水在光照的条件下,可以产生气体,该气体是氯气
C.新制氯水中滴加硝酸银溶液,没有任何现象
D.新制氯水中滴加石蕊试液,变红后褪色,而久置的氯水没有漂白性
难度: 简单查看答案及解析
-
下列说法不正确的是
A.硫单质与金属铁反应生成FeS,体现了硫单质的氧化性
B.H2S既具有还原性,又具有氧化性
C.SO2能使酸性KMnO4溶液、氯水褪色,说明SO2具有漂白性。
D.SO2在一定条件下可转化为SO3
难度: 中等查看答案及解析
-
元素周期表是学习化学的重要工具,下列关于元素周期表的说法不正确的是
A.第7周期的最后一种元素为118号元素
B.电子层数相等的元素都在同一周期
C.元素周期表中ⅠA族是包含元素种类最多的纵列
D.元素周期表中共有18个纵列,其中ⅠA~ⅦA族每个纵列至少有6种元素
难度: 简单查看答案及解析
-
下列描述的元素中,一定属于主族元素的有()
A.元素的原子最外层电子个数为2
B.元素的原子最外层电子个数为6
C.位于元素周期表中ⅡA族右边的元素
D.阴离子RO4﹣中R元素
难度: 中等查看答案及解析
-
下列现象或事实可用同一原理解释的是
A.新制的氨水、氯水放置时间较久而变质
B.
能使溴水和品红溶液褪色
C.
和
溶液使酸性高锰酸钾溶液的紫色褪去
D.浓硫酸和浓盐酸长期暴露在空气中浓度降低
难度: 简单查看答案及解析
-
X、Y、Z、W四种短周期主族元素的原子序数依次增大。X、Y原子的最外层电子数之比为2∶3,Z+与Y2-核外电子排布完全相同,常温下,W的一种单质为淡黄色固体。下列说法不正确的是
A.简单离子半径:W2->Z+>Y2-
B.简单气态氢化物的热稳定性:H2Y>H2W
C.Y能分别与X、Z、W形成两种或两种以上的化合物
D.Z与Y形成的化合物溶于水,溶液均呈碱性
难度: 简单查看答案及解析
-
下列说法正确的是
A.某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子
B.最外层电子达稳定结构的微粒只能是稀有气体的原子
C.NH4+与OH-具有相同的质子数和电子数
D.F-、Na+、Mg2+、Al3+是与Ne原子具有相同电子层结构的离子
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.原子的L层上的电子数为奇数的元素一定是主族元素
B.同一周期的ⅡA族和ⅢA族元素的原子序数之差一定为1
C.相邻两个周期的同一主族元素的原子序数之差等于上一周期所含元素种类
D.主族序数等于周期序数的元素一定为金属元素
难度: 中等查看答案及解析
-
16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是
A.16O与18O互为同素异形体
B.16O与18O核外电子排布方式不同
C.通过化学变化可以实现16O与18O间的相互转化
D.标准状况下,11.2L16O2和11.2L18O2均含NA个氧原子
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
B.常温下,铜片放入浓硫酸中,无明显变化,说明铜在冷的浓硫酸中发生钝化
C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
难度: 中等查看答案及解析
-
四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是( )
①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物碱性X>Y
A.③ B.①②③④ C.①②③ D.②③
难度: 中等查看答案及解析
-
将SO2通入BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体A,则产生白色沉淀。制备气体A的试剂不能是
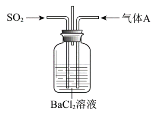
A.大理石和稀盐酸 B.Ca(OH)2和NH4Cl
C.Cu和浓硝酸 D.MnO2和浓盐酸
难度: 中等查看答案及解析
-
表中元素①~⑧均为短周期元素:
①
②
③
④
⑤
⑥
⑦
⑧
原子半径/nm
0.074
0.160
0.152
0.110
0.099
0.186
0.075
0.143
最外层电子数
6
2
3
常见化合价
+1
-3、+5
-3、+5
焰色试验
黄色
单质的颜色
黄绿色
结合表中的有关信息,下列说法正确的是
A.元素③、⑥都是碱金属元素 B.元素的非金属性:⑤<④
C.元素⑥、②、⑧的金属性逐渐增强 D.元素⑧的单质是半导体
难度: 中等查看答案及解析
-
用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)其中正确的是

选项
气体
a
b
c
d
A
CO2
盐酸
CaCO3
饱和Na2CO3溶液
浓硫酸
B
Cl2
浓盐酸
MnO2
NaOH溶液
浓硫酸
C
NH3
饱和NH4Cl溶液
消石灰
H2O
固体NaOH
D
NO
稀硝酸
铜屑
H2O
浓硫酸
A. A B. B C. C D. D
难度: 中等查看答案及解析