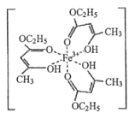
-
下列能级符号表示正确且最多容纳的电子数按照从少到多的顺序排列的是
A.1s、2p、3d B.1s、2s、3s
C.2s、2p、2d D.3p、3d、3f
难度: 简单查看答案及解析
-
下列叙述中正确的是
A.NH3、CO、CO2 都是极性分子
B.CH4、CCl4 都是含有极性键的非极性分子
C.HF、HCl、HBr、HI 的稳定性依次增强
D.CS2、H2O、C2H2 都是直线形分子
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. σ键比π键重叠程度大,形成的共价键强
B. 两个原子之间形成共价键时,最多有一个σ键
C. 气体单质中,一定有σ键,可能有π键
D. N2分子中有一个σ键,2个π键
难度: 中等查看答案及解析
-
已知氯化铬的水合物为CrCl3·6H2O,其中铬元素的配位数是6,将含0.1 mol氯化铬的水溶液用过量稀硝酸银溶液处理时,只得到0.2 mol AgCl沉淀,则氯化铬溶于水中的含铬阳离子为
A. Cr3+ B. [CrCl2(H2O)4]+ C. [CrCl(H2O)5]2+ D. [Cr(H2O)6]3+
难度: 中等查看答案及解析
-
下列各原子或离子的电子排布式错误的是( )
A.K+:1s22s22p63s23p6 B.As:1s22s22p63s23p63d104s24p3
C.N3-:1s22s22p6 D.Ca:1s22s22p63s23p63d2
难度: 简单查看答案及解析
-
下列物质中,既含有离子键又含有共价键的是
A.氯化钠 B.氢氧化钠 C.水 D.氯气
难度: 中等查看答案及解析
-
用VSEPR模型预测下列分子或离子的立体结构,其中不正确的是( )
A.NH4+为正四面体形
B.CS2为直线形
C.HCN为折线形(V形)
D.PCl3为三角锥形
难度: 简单查看答案及解析
-
下列分子或离子的中心原子,带有一对孤电子对的是
A.H2O B.BeCl2 C.CH4 D.PCl3
难度: 中等查看答案及解析
-
下列属于分子晶体性质的是
A. 组成晶体的微粒是离子
B. 能溶于CS2,熔点为112.8℃,沸点为444.6℃
C. 熔点为1 400℃,可作半导体材料,难溶于水
D. 熔点高,硬度大
难度: 简单查看答案及解析
-
已知X、Y是主族元素,I为电离能,单位是kJ•mol-1。根据下表所列数据判断错误的是
电离能
元素
I1
I2
I3
I4
X
496
4562
6912
9543
Y
578
1817
2745
11600
A.元素X的常见化合价是+1价
B.元素Y是ⅢA族的元素
C.元素X与氧形成化合物时,化学式可能是X2O2
D.若元素Y处于第三周期,则它可与冷水剧烈反应
难度: 简单查看答案及解析
-
向盛有硫酸铜水溶液的试管中加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列说法正确的是( )
A.沉淀溶解后,将生成深蓝色的配离子[Cu(NH3)4]2+
B.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
C.上述现象说明[Cu(NH3)4]2+不如Cu(OH)2稳定
D.在[Cu(NH3)4]2+中,Cu2+给出孤对电子,NH3提供空轨道
难度: 简单查看答案及解析
-
CaO晶胞如图所示,其中Ca2+的配位数为( )
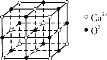
A.4 B.6 C.8 D.12
难度: 简单查看答案及解析
-
下列由电子排布式或排布图所得的结论错误的是( )
选项
电子排布式
结论
A
1s22s22p
2p
2p
违背洪特规则
B
1s22s22p63s23p63d3
违背能量最低原理
C
N的电子排布图:
违背泡利原理
D
1s22s22p63s23p63d54s1
违背能量最低原理
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
如图所示是从NaCl或CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( )
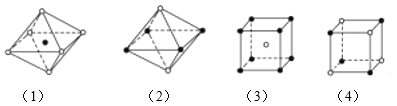
A.(1)和(3) B.(2)和(3) C.(1)和(4) D.只有(4)
难度: 简单查看答案及解析
 模型中的小黑点表示电子在原子核外出现的概率密度的形象描述______。
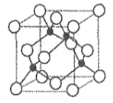
模型中的小黑点表示电子在原子核外出现的概率密度的形象描述______。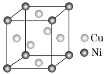 某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为________。
某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为________。