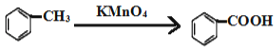-
化学在生产和生活中有重要的应用。下列说法正确的是
A.新型材料聚酯纤维、光导纤维都属于有机高分子
B.14C可用于文物年代的鉴定,14C与12C互为同素异形体
C.凡含有添加剂的食物对人体健康均有害,不宜食用
D.“开发利用新能源”、“汽车尾气催化净化”都能提高空气质量
难度: 简单查看答案及解析
-
下列叙述正确的( )
A.常温下,将铝箔插入浓HNO3中,无明显现象,说明铝和浓硝酸不反应
B.用熔融的AlCl3做导电性实验,验证AlCl3是离子化合物还是共价化合物
C.用洁净的铂丝蘸取溶液进行焰色反应,观察到火焰呈黄色,该溶液一定是钠盐溶液
D.常温下,用pH试纸测定0.1mol·L-1盐酸的pH,证明HCl是强酸
难度: 中等查看答案及解析
-
有机物
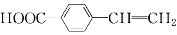 在医药合成中有着广泛的用途。下列有关该物质的说法正确的( )
在医药合成中有着广泛的用途。下列有关该物质的说法正确的( )A.该化合物中含氧官能团为酯基
B.该化合物中的所有碳原子一定处于同一平面内
C.该化合物可发生取代反应、加成反应和氧化反应
D.该化合物的同分异构体中,苯环上有两个取代基的共3种
难度: 中等查看答案及解析
-
a、b、c、d、e五种短周期元素的原子半径与原子序数的关系如下图,下列说法错误的是( )
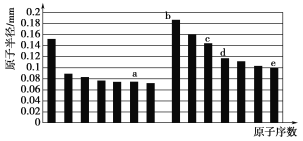
A. a、e两种元素的气态氢化物的沸点相比,前者较高
B. c、e两种元素的离子半径相比,前者较小
C. 由a与d两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D. c的氧化物能溶于b的氢氧化物的水溶液和e的氢化物的水溶液
难度: 中等查看答案及解析
-
下列有关实验操作、现象记录、结论解释都正确的是
实验操作
现象记录
结论解释
A
将pH试纸润湿,置于盛有HCl气体的集气瓶口
试纸变红
HCl是酸性气体
B
向2 mL___1___mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液
先生成白色沉淀,后转化为红褐色沉淀
Mg(OH)2溶解度大于Fe(OH)3
C
将少量浓硝酸逐滴加入盛有FeSO4稀溶液的试管中
试管口产生红棕色气体
硝酸被还原为NO2
D
向紫色石蕊试液中加Na2O2粉末
溶液变蓝,且不褪色
Na2O2溶于水生成碱性物质
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
流动电池可以在电池外部调节电解质溶液,从而维持电池内部电解质溶液浓度稳定,原理如图。下列说法错误的是
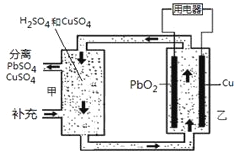
A.Cu为负极
B.PbO2电极的电极反应式为:PbO2 + 4H+ + SO42-+ 2e-= PbSO4 + 2H2O
C.甲中应补充硫酸
D.当消耗1 mol PbO2,需分离出2 mol CuSO4
难度: 中等查看答案及解析
-
亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,将KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液的pH关系如图所示。下列说法正确的( )
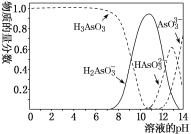
A.人体血液的pH在7.35~7.45之间,用药后人体中含As元素的主要微粒是AsO33-
B.n(H3AsO3)∶n(H2AsO3-)=1∶1时,溶液显酸性
C.当pH调至11时发生反应的离子方程式是H3AsO3+OH-=H2AsO3-+H2O
D.pH=12时,溶液中c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(OH-)=c(H+)
难度: 中等查看答案及解析
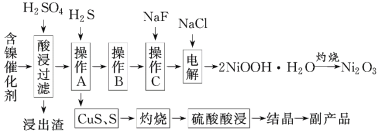
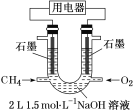
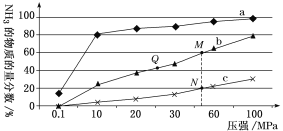
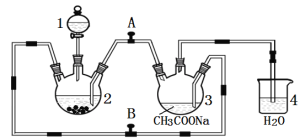
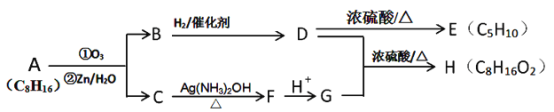
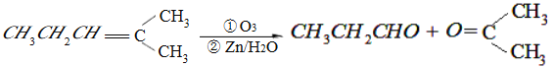
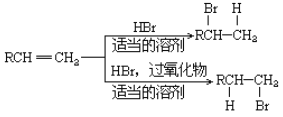 。
。