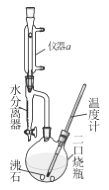
-
化学与生活密切相关。下列叙述中错误的是
A.环境中杀灭新型冠状病毒可用“84”消毒液
B.食品中的抗氧化剂可用维生素C
C.治疗胃酸过多可用CaCO3和Ca(OH)2
D.除去工业废水中的Cu2+可用FeS
难度: 简单查看答案及解析
-
下列关于有机物的说法正确的是
A.聚氯乙烯高分子中所有原子均在同一平面上
B.乙烯和苯使溴水褪色的反应类型相同
C.石油裂化是化学变化
D.葡萄糖与蔗糖是同系物
难度: 简单查看答案及解析
-
阿伏加德罗常数为NA。关于 l00mLl mol/L的Fe2(SO4)3溶液,下列说法正确是
A.加NaOH可制得Fe(OH)3 胶粒0.2NA
B.溶液中阳离子数目为0.2NA
C.加Na2CO3 溶液发生的反应为 3CO32-+ 2Fe3+ = Fe2(CO3 )3↓
D.Fe2(SO4)3溶液可用于净化水
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W 的原子序数依次增大。X 原子的最外层电子数是K 层电子数的3倍;Z 的原子半径在短周期中最大;常温下,Z和W形成的化合物的水溶液pH > 7, 呈弱碱性。下列说法正确的是
A.X 与W 属于同主族元素
B.最高价氧化物的水化物酸性:W<Y
C.简单氢化物的沸点:Y > X > W
D.Z 和W的单质都能和水反应
难度: 简单查看答案及解析
-
下列实验操作及现象,不能得出对应结论的是
选项
实验操作
现象
结论
A
将甲烷与氯气在光照下反应,反应后的混合气体通入紫色石蕊试液中
紫色石蕊试液变红且不褪色
反应产生了HCl
B
镀锌铁片出现刮痕后部分浸入饱和食盐水中,一段时间后铁片附近滴入K3[Fe(CN)6]溶液
无蓝色沉淀
镀锌铁没有发生原电池反应
C
向 2mL 0.l mol/L 醋酸溶液和 2mL0.l mol/L 硼酸溶液中分别滴入少量0.lmol/LNaHCO3 溶液
只有醋酸溶液中产生气体
酸性:醋酸>碳酸>硼酸
D
向 FeCl3 溶液与 NaCl 溶液中分别滴入 30% H2O2 溶液
只有FeCl3 溶液中迅速产生气体
Fe3+能催H2O2分解
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
利用固体燃料电池技术处理 H2S废气并发电的原理如图所示 。根据不同固体电解质M因传导离子的不同,分为质子传导型和氧离子传导型,工作温度分别为 500℃和 850℃左右,传导质子时的产物硫表示为Sx。下列说法错误的是

A.气体X 是H2S废气,气体Y 是空气
B.M传导质子时,负极a 反应为:xH2S—2xe-=Sx+2xH+
C.M传导氧离子时,存在产生SO2污染物的问题
D.氧离子迁移方向是从a 电极向b 电极
难度: 简单查看答案及解析
-
常温下向 0.l mol/L 的NaClO 溶液中通入 HF 气体,随反应进行(不考虑HClO分解),溶液中lg
( A 代表ClO 或F) 的值和溶液pH 变化存在如图所示关系,下列说法正确的是
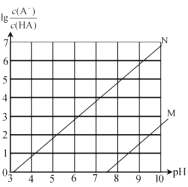
A.线N 代表lg
的变化线
B.反应ClO-+HF ⇌ HCIO+F- 的平衡常数数量级为 105
C.当混合溶液pH= 7 时,溶液中c(HClO) = c(F- )
D.随HF 的通入,溶液中c(H+) •c(OH- )增大
难度: 中等查看答案及解析