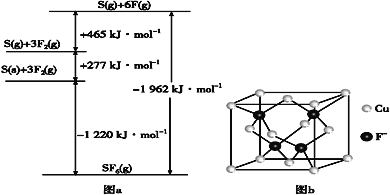
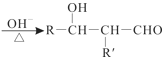-
下列有关化学及人类社会发展历程的说法中,正确的是( )
A.道尔顿的“原子论”和阿伏加德罗的“分子学说”对化学的发展起到了极大的推动作用
B.门捷列夫将元素按原子序数由小到大的顺序依次排列,制出了第一张元素周期表
C.《本草纲目》中有关“石碱”的一条记载为:石碱出山东济宁诸处,彼人采篙寥之属,晒干灰,以水淋汁,久则凝淀如石,洗衣发面,亦去垢发面。这里的“石碱”是指氢氧化钠
D.《茶疏》中对泡茶过程有如下记载:“治壶、投茶、出浴、淋壶、烫杯、酾茶、品茶……”文中涉及过滤和蒸馏等化学实验操作方法
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述错误的是( )
A.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
B.1molNaBH4与足量水反应生成NaBO2和H2时转移的电子数为4NA
C.25℃,1LpH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9NA
D.相同质量的Na2O2和Na2S固体具有相同的阴阳离子数和质子数
难度: 中等查看答案及解析
-
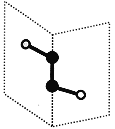
短周期主族元素X、Y、Z、W的原子序数依次递增,其中Y与Z同主族。X与Y、Z与W均可形成如图所示的分子结构,且Z与W形成的分子中所有原子最外层均满足8电子稳定结构。下列说法中正确的是( )
A.离子半径:W>Z>Y>X
B.ZY2和WY2都可以使品红溶液褪色但褪色原理不同
C.氧化物对应的水化物的酸性:W>Z
D.X2Y2,Z2W2均含有非极性共价键且各原子都满足8电子的稳定结构
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.碘化亚铁溶液中通入过量氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
B.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
C.用铜作电极电解CuSO4溶液:2Cu2++2H2O
2Cu+O2↑+4H+
D.1mol•L-1的NaAlO2溶液和2.5mol•L-1的HCl溶液等体积互相均匀混合:2AlO2-+5H+=Al3++Al(OH)3↓+H2O
难度: 中等查看答案及解析
-
下列有关实验操作、现象和结论都正确的是( )
选项
实验操作
现象
结论
A
向氢氧化铁胶体中滴加过量硫酸溶液
有红褐色沉淀
胶体遇强电解质聚沉
B
溶有SO2的BaCl2溶液中通入气体X
有沉淀产生
X可能是H2S气体
C
将灼烧至红热的铜丝插入乙醇中
铜丝由黑变红
乙醇被还原
D
向某溶液中滴加少量的稀NaOH溶液并加热,将红色石蕊试纸置于试管口
试纸变蓝
该溶液中存在NH4+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列有关有机物的说法正确的是( )
A.螺[3,3]庚烷(
)的二氯代物共有2种(不含立体异构)
B.乙烯和丙烯加成聚合最多可形成2种有机高分子化合物
C.对甲基苯乙烯分子中最多有17个原子共面
D.用氢氧化钠溶液无法鉴别矿物油和植物油
难度: 困难查看答案及解析
-
常温下,向50mL溶有0.1molCl2的氯水中滴加2mol·L-1的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图像如图所示。下列说法正确的是( )

A.a点溶液中存在:N(HClO)+N(Cl-)+N(ClO-)=0.2NA(N表示粒子数),若想增加a点溶液的漂白能力可向溶液中加入碳酸钙固体
B.若a点pH=4,且c(Cl-)=m·c(ClO-),则Ka(HClO)=
C.b~c段,随NaOH溶液的滴入,
逐渐增大
D.若y=200,则c点对应溶液中:c(HClO)+c(H+)=c(OH-)-2c(Cl-)
难度: 困难查看答案及解析
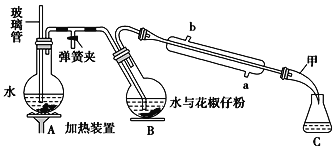
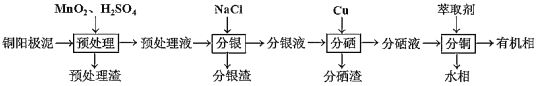
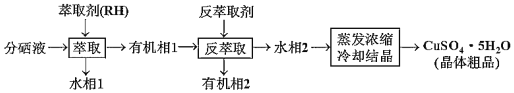
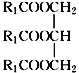 表示)
表示)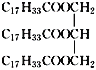 计,式量:884)。
计,式量:884)。