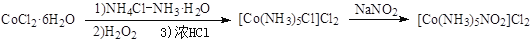-
下列各组原子中彼此化学性质一定相似的是( )
A. 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B. 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C. 2p轨道上有一对成对电子的X原子和3p轨道上只有一对成对电子的Y原子
D. 最外层都只有一个电子的X、Y原子
难度: 困难查看答案及解析
-
W、X、Y、Z、R为原子序数依次增大的短周期主族元素,W元素的一种核素可用于鉴定文物年代,X元素的一种单质可作为饮用水消毒剂,Y元素的简单离子是同周期元素的简单离子中半径最小的,Z元素和W元素同主族,R元素被称为“成盐元素”。下列说法错误的是
A. W元素和X元素形成的化合物WX2属于非极性分子
B. 工业上常用电解熔融Y元素和R元素形成的化合物的方法来制取单质Y
C. 制造日常生活中所使用的计算机芯片需要消耗大量单质Z
D. X元素和R元素形成的某种化合物可用于自来水的消毒
难度: 困难查看答案及解析
-
锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O===2Zn(OH)42-。下列说法正确的是( )
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-) 逐渐减小
C.放电时,负极反应为:Zn+4OH–-2e–= Zn(OH)42-
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.在多电子的原子里,能量高的电子通常在离核近的区域内活动
B.核外电子总是先排在能量低的电子层上,例如只有排满了L层后才排M层
C.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
D.微粒的最外层只能是8个电子才稳定
难度: 中等查看答案及解析
-
下列能级中,能级符号正确且轨道数为5的是( )
A.2d B.3p C.4d D.5s
难度: 简单查看答案及解析
-
X、Y、Z表示三种元素的原子,其最外层电子排布分别为ns1、3s23p4和2s2p4,由这三种元素组成的化合物的化学式可能是
A.XYZ2 B.XYZ3 C.X2Y2Z3 D.X3YZ4
难度: 简单查看答案及解析
-
Co(Ⅲ)的八面体配合物CoClm·nNH3,若1 mol该配合物与AgNO3作用生成1 mol AgCl沉淀,则m、n的值是
A.m=1,n=5 B.m=3,n=4
C.m=5,n=1 D.m=4,n=5
难度: 困难查看答案及解析
-
下列原子轨道表示式中,表示氧原子的基态电子轨道排布式正确的是
A.
 B.
B.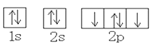
C.
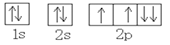 D.
D.
难度: 简单查看答案及解析
-
前四周期元素X、Y、Z、W、T的原子序数依次增大,Y、Z、W位于同一周期,X的最简单氢化物分子的空间结构为正四面体,Y在同周期中电负性最小,二元化合物E中元素Y和W的质量比为23:16;同周期元素简单离子中,元素Z形成的离子半径最小;T元素的价电子排布式为3d104s1。下列说法正确的是( )
A.简单离子的半径Y>Z>W
B.最高价氧化物对应水化物的酸性W>Z>X
C.W和T的单质混合加热可得化合物T2W
D.W的单质在足量的氧气中燃烧,所得产物溶于水可得强酸
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期主族元素,它们在周期表中的相对位置如图所示,下列说法中正确的是( )
A.Y的价层电子排布式是
B.四种元素所形成的最简单氢化物中,沸点最高的是可能Y的氢化物
C.Y、Z之间可形成离子型化合物
D.X、Z、W的最高价氧化物所对应的水化物不可能均是强酸
难度: 困难查看答案及解析
-
第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中正确的是( )
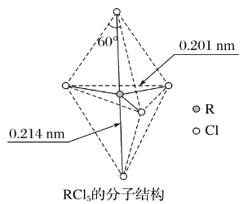
A. 每个原子都达到8电子稳定结构
B. 键角(Cl—R—Cl)有90°、120°、180°几种
C. RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
D. 分子中5个R—Cl键键能不相同
难度: 困难查看答案及解析
-
短周期主族元素A、B形成AB3型分子,下列有关叙述正确的是( )
A. 若A、B为同一周期元素,则AB3分子一定为平面正三角形
B. 若AB3分子中的价电子个数为24个,则AB3分子为平面正三角形
C. 若A、B为同一主族元素,,则AB3分子一定为三角锥形
D. 若AB3分子为三角锥形,则AB3分子一定为NH3
难度: 困难查看答案及解析
-
以NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.36g冰(图甲)中含共价键数目为4NA

B.12g金刚石(图乙)中含有σ键数目为4NA
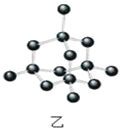
C.44g干冰(图丙)中含有NA个晶胞结构单元
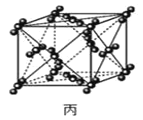
D.12g石墨(图丁)中含σ键数目3NA
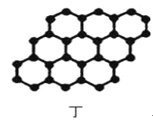
难度: 困难查看答案及解析
-
高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价,如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )
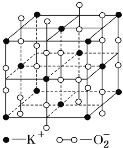
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个,晶体中与每个O2-距离最近的O2-有6个
D.晶体中其中0价氧和-2价氧的物质的量之比为1:1
难度: 中等查看答案及解析
-
已知P4单质的结构如下,P4在 KOH 溶液中的变化是:P4 + 3KOH + 3H2O = 3KH2PO2 + PH3 ↑,下列说法正确的是( )
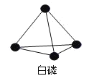
A.产物 PH3分子中所有的原子可能共平面
B.31gP4含有 1.5NA个 P − P 键
C.相关元素的电负性大小顺序:P > O > H > K
D.P4中 P 原子为 sp2杂化
难度: 简单查看答案及解析
-
下列叙述不正确的是
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3
⑥已知2H2(g)+O2(g)=2H2O(l) △H=﹣571kJ·mol﹣1,则氢气的燃烧热为285.5kJ·mol﹣1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
A.②④⑥ B.①③⑤⑦ C.②④⑥⑦ D.⑤⑥⑦
难度: 困难查看答案及解析
-
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是
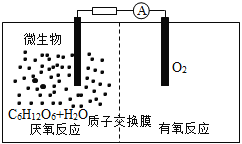
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
难度: 中等查看答案及解析
-
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
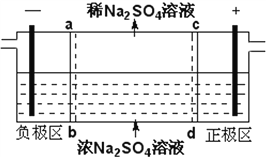
A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
难度: 中等查看答案及解析