-
硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4。回答下列问题:
(1)写出基态Zn原子的价电子排布式__,基态S原子核外未成对电子数为__。
(2)ZnSO4中三种元素的电负性由大到小的顺序为__,SO42-的立体构型为__,其中S的杂化轨道类型为__。
(3)硫酸锌溶于氨水可生成[Zn(NH3)4]SO4溶液,[Zn(NH3)4]SO4溶液中不存在的微粒间作用力有__。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
(4)根据下列锌卤化物的熔点和溶解性,分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因__。
| ZnF2 | ZnCl2 | ZnBr2 | ZnI2 |
| 熔点/℃ | 872 | 275 | 394 | 446 |
| 在乙醇、乙醚中溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
(5)钾晶体晶胞结构如图所示,距离最近的两个钾原子距离为acm,阿伏加德罗常数为NA。
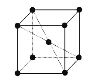
①钾原子核外运动状态不同的电子数是___。
②钾晶体的密度是___。
-
[化学—选修3:物质结构与性质]
硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4。回答下列问题:
⑴写出基态Zn原子的价电子排布式__________,基态S原子核外未成对电子数为_____。
⑵ZnSO4中三种元素的电负性由大到小的顺序为_____________________,SO42-的立体构型为________________,其中S的杂化轨道类型为_________。
⑶硫酸锌溶于氨水可生成[Zn(NH3)4]SO4溶液,[Zn(NH3)4]SO4溶液中不存在的微粒间作用力有___________。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
⑷根据下列锌卤化物的熔点和溶解性,判断ZnF2晶体的类型为___________;分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因________________。
| ZnF2 | ZnCl2 | ZnBr2 | ZnI2 |
| 熔点/℃ | 872 | 275 | 394 | 446 |
| 在乙醇、乙醚中溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
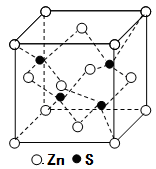
⑸立方ZnS晶体的密度为ρg·cm-3,其晶胞结构如图。S2-周围等距离且最近的Zn2+、S2-依次为______、______;ZnS晶胞中的晶胞参数a=________nm(列出计算式)。
-
(NH4)2Fe(SO4)2•6H2O(莫尔盐,浅绿色,式量392)在定量分析中常用作标定高锰酸钾、重铬酸钾等溶液的标准物质,还用作化学试剂、医药以及用于冶金、电镀等。
回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是________;
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加人20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点.重复进行3次,测得有关数据如下:
| 实验序号 | 起始读数/mL | 终点读数/mL |
| I | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.12 |
| Ⅲ | 0.00 | 19.92 |
①K2Cr2O7溶液应该放在________式滴定管中.
②写出滴定过程中反应的离子方程式:________;
③所测K2Cr2O7溶液的物质的量浓度为________mol/L(用含M的代数式表示)
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物。
①甲同学提出猜想:分解产物可能是N2、Fe2O3,SO3、H2O四种物质.你是否同意并说明理由:________;
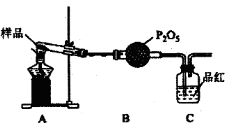
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有________;C装置中红色褪去,说明气体产物中含有________;C装置后应连接尾气吸收装置D,D中盛有的试剂可以是________(写一种即可)。
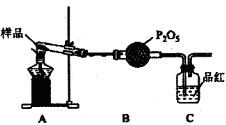
③丙同学想利用上述装置证明分解产物中含有氨气.只需更换B,C中的试剂即可,则更换后的试剂为B________、C________;
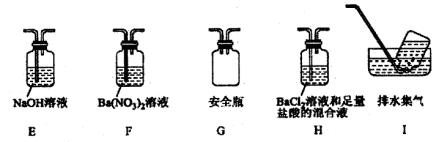
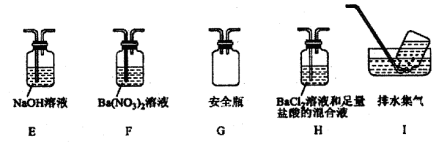
④丁同学认为莫尔盐分解可能会生成N2,SO3,拟从下列装置如图2中选择必要的装置加以证明.则正确的连接顺序从左到右依次是A、________。
-
(NH4)2Fe(SO4)2•6H2O(莫尔盐,浅绿色,式量392)在定量分析中常用作标定高锰酸钾、重铬酸钾等溶液的标准物质,还用作化学试剂、医药以及用于冶金、电镀等。
回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是________;
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加人20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点.重复进行3次,测得有关数据如下:
| 实验序号 | 起始读数/mL | 终点读数/mL |
| I | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.12 |
| Ⅲ | 0.00 | 19.92 |
①K2Cr2O7溶液应该放在________式滴定管中.
②写出滴定过程中反应的离子方程式:________;
③所测K2Cr2O7溶液的物质的量浓度为________mol/L(用含M的代数式表示)
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物。
①甲同学提出猜想:分解产物可能是N2、Fe2O3,SO3、H2O四种物质.你是否同意并说明理由:________;
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有________;C装置中红色褪去,说明气体产物中含有________;C装置后应连接尾气吸收装置D,D中盛有的试剂可以是________(写一种即可)。
③丙同学想利用上述装置证明分解产物中含有氨气.只需更换B,C中的试剂即可,则更换后的试剂为B________、C________;
④丁同学认为莫尔盐分解可能会生成N2,SO3,拟从下列装置如图2中选择必要的装置加以证明.则正确的连接顺序从左到右依次是A、________。
-
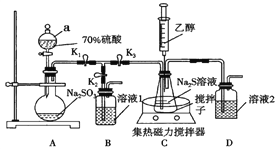
硫代硫酸钠(Na2S2O3)是常用的定影剂、还原性分析试剂。Na2S2O3·5H2O是无色晶体,易溶于水,不溶于乙醇,在潮湿的空气中易潮解,Na2S2O3和甲醛能形成难被碘溶液氧化的化合物。甲、乙两个兴趣小组用下列装置在实验室制备硫代硫酸钠。
回答下列问题:
(1)仪器a的名称是____________;溶液1是____________。
(2)甲小组按上图连接好装置,打开K1、K3,关闭K2,打开仪器a的活塞;片刻后,打开集热式磁力搅拌器加热;将气体通入锥形瓶中,溶液出现黄色浑浊后逐渐消失,相关的化学反应方程式为:①_________________;②Na2SO3+S Na2S2O3。
Na2S2O3。
(3)加热浓缩至出现少量晶膜,停止加热,打开K2,关闭K3,用注射器注入无水乙醇后有大量晶体析出。加入乙醇的作用是__________________________________。
(4)乙小组在制备Na2S2O3时进行了改进。将C装置中的溶液换为Na2CO3和Na2S混合液,其反应为:Na2CO3+Na2S+4SO2=3Na2S2O3+CO2。配制该混合溶液的过程中,先将Na2CO3完全溶解,再将Na2S溶解于Na2CO3的溶液中,其目的是__________________。
(5)测定乙小组产品纯度。取3.000 g Na2S2O3·5H2O晶体,配成100 mL溶液,取20.00 mL于锥形瓶,调节溶液的pH至6,加入适量甲醛溶液和Zn(CH3COO)2溶液,过滤,洗涤,在滤液中滴加几滴淀粉溶液,用0.1000mol/L标准碘溶液滴定,消耗标准碘溶液10.00 mL。
①加入适量甲醛溶液和Zn(CH3COO)2溶液的目的是_________________________________。
②该产品中Na2S2O3·5H2O的质量分数为_____________。 (已知:2Na2S2O3+I2=Na2S4O6+2NaI Ksp(ZnS)=1.6×10-24 M(Na2S2O3·5H2O)=248 g/mol)
-
常温下,Ksp(ZnS)=l.6×10-24,Ksp(FeS)=6.4×10-18,其中FeS为黑色晶体,ZnS是一种白色颜料的组成成分。下列说法正确的是
A.向物质的量浓度相等的FeSO4和ZnSO4混合液中滴加Na2S溶液,先产生黑色沉淀
B.常温下,反应FeS(s)+Zn2+(aq)⇌ZnS(s)+Fe2+(aq)的平衡常数K=4.0×l06
C.在ZnS的饱和溶液中,加入FeSO4溶液,一定不会产生FeS沉淀
D.向FeS悬浊液中通入少许HC1,c(Fe2+)与Ksp(FeS)均增大
-
锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
Ⅰ.ZnSO4溶液的制备与提纯:

有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)若②中加入氧化剂为H2O2,写出离子反应方程式____。
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤___(选填①、②、③、⑤)。
(3)滤渣2的主要成分为___。
(4)写出步骤④后产生滤渣3的离子反应方程式___。
Ⅱ.BaS溶液的制备:

(5)写出煅烧还原的化学反应方程式____。
Ⅲ.制取锌钡白:
(6)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是___。
-
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡,根据要求回答下列问题:
(1)向 ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀,用电离平衡原理解释上述现象 _______________________________________________ 。
(2)AlCl3溶液蒸干并灼烧得到的物质是__________ (填化学式)。
(3)0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为________________________________________。
(4)0.1mol·L-1的NaHA溶液中,粒子浓度由大到小的顺序为:c(Na+)>c(HA—)>c(H2A)>c(A2-)
①该溶液中显________(填“酸性”、“碱性”或“中性”);
②作出上述判断的依据是___________________________________________(用文字解释)。
-
自然界地表层铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗透,遇到难溶的ZnS,慢慢转变为CuS。下列分析正确的是
A.铜的硫化物具有氧化性
B.CuS的溶解度大于ZnS的溶解度
C.CuSO4与ZnS反应的离子方程式是Cu2++ S2— = CuS↓
D.以上过程涉及到了氧化还原反应和复分解反应
-
黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物。室温为非活性物质。温度升高后变得活泼。在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:

回答下列问题:
(1)在FeS2中的S2-的核外电子排布式是________________________;
(2)常温下Fe3+比Fe2+要更加稳定的原因是__________________________________;
(3)将FeS2与稀盐酸反应得到H2S2,H2S2分子中,共价键的类型是___________________;FeS2氧化得到SO2,在SO2分子中的S原子的杂化轨道类型是______________________ ,写出两个与SO2互为等电子体的分子或离子_______________________。-
(4)H2SO4和H2SO3都是S的含氧酸,请用结构知识解释H2SO4比H2SO3酸性强的原因:
_____________________________________________________________________。
(5)FeS2的晶体中的Fe2+离子的排列方式如下图。

①每个Fe2+周围最近的等距离的S22-离子有____________个。
②已知FeS2的晶胞参数是a0=0.54nm,它的密度为_____________________g·cm-3(列式并计算,阿伏加德罗常数为6.02×1023)。










