-
设NA为阿伏加德罗常数的值,下列说法不正确的是
A.1L0.1mol·L-1Fe2(SO4)3溶液中含有的阳离子数目小于0.2NA
B.0.24g Mg在O2和CO2的混合气体中完全燃烧,转移电子数为0.02NA
C.3g由CO2和SO2组成的混合气体中含有的质子数为1.5NA
D.1molNa2O2与SO2完全反应,转移电子数为2NA
难度: 中等查看答案及解析
-
化学现象随处可见,化学制品伴随我们的生活。下列说法错误的是( )
A.“霾尘积聚难见路人”,雾霾可能产生丁达尔效应
B.“用浓酒和糟入甑(蒸锅),蒸令气上……”,其中涉及的操作是蒸馏
C.“世间丝、麻、裘皆具素质……”,其中的“丝、麻”的主要成分都是蛋白质
D.古剑“沈卢”以“剂钢为刃,柔铁为茎干,不尔则多断折”,其中的“剂钢”是铁合金
难度: 简单查看答案及解析
-
《学习强国》学习平台说“最基本的生命分子中都有碳原子”。
常用于测定文物的年代,
作为示踪原子对研究有机化学反应和生物化学反应更为方便。
被用来作为阿伏伽德罗常数的标准。关于
、
、
说法正确的是( )
A. 质子数与质量数相同 B. 化学性质相似
C. 互为同素异形体 D. 质子数与中子数相等
难度: 简单查看答案及解析
-
氮及其化合物的转化过程如下图所示,其中如图为反应①过程中能量变化的曲线图。
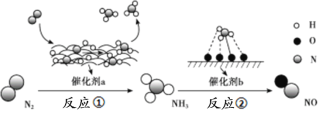
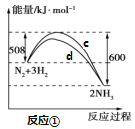
下列分析合理的是
A.如图中c曲线是加入催化剂a时的能量变化曲线
B.反应①的热化学方程式为:N2(g)+3H2(g)
2NH3(g) ΔH=-92 kJ/mol
C.在反应②中,若有1.25 mol电子发生转移,则参加反应的NH3的体积为5.6 L
D.催化剂a、b能提高化学反应①、②的化学反应速率和平衡转化率
难度: 中等查看答案及解析
-
有机化合物在食品、药物、材料等领域发挥着举足轻重的作用。下列说法正确的是( )
A.甲苯和间二甲苯的一溴代物均有4种
B.按系统命名法,化合物(CH3)2C(OH)C(CH3)3的名称为2,2,3-三甲基-3-丁醇
C.2-丁烯分子中的四个碳原子在同一直线上
D.乙酸甲酯分子在核磁共振氢谱中只能出现一组峰
难度: 中等查看答案及解析
-
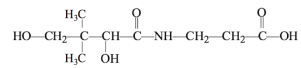
泛酸和乳酸均易溶于水并能参与人体代谢,结构简式如下图所示。下列说法不正确的是
泛酸
 乳酸
乳酸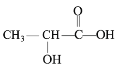
A.泛酸分子式为C9H17NO5
B.泛酸在酸性条件下的水解产物之一与乳酸互为同系物
C.泛酸易溶于水,与其分子内含有多个羟基易与水分子形成氢键有关
D.乳酸在一定条件下反应,可形成六元环状化合物
难度: 中等查看答案及解析
-
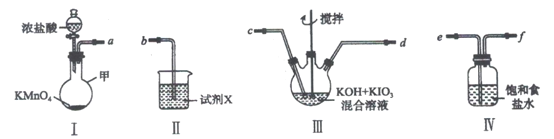
实验室为探究铁与浓硫酸
足量
的反应,并验证
的性质,设计如图所示装置进行实验,下列说法不正确的是()
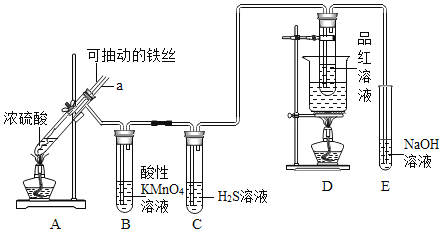
A.装置B中酸性
溶液逐渐褪色,体现了二氧化硫的还原性
B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的
C.装置D中品红溶液褪色可以验证
的漂白性
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸
难度: 简单查看答案及解析
-
工业上用发烟HClO4把潮湿的CrCl3氧化为棕色的烟[CrO2(ClO4)2]来除去Cr(Ⅲ),HClO4中部分氯元素转化为最低价态。下列说法不正确的是( )
A.HClO4属于强酸,反应还生成了另一种强酸
B.该反应中,参加反应的氧化剂与氧化产物的物质的量之比为3∶8
C.CrO2(ClO4)2中Cr元素显+6价
D.该反应离子方程式为19ClO4-+8Cr3++8OH-=8CrO2(ClO4)2+3Cl-+4H2O
难度: 困难查看答案及解析
-
前四周期元素X、Y、Z、W、T的原子序数依次增大,Y、Z、W位于同一周期,X的最简单氢化物分子的空间结构为正四面体,Y在同周期中电负性最小,二元化合物E中元素Y和W的质量比为23:16;同周期元素简单离子中,元素Z形成的离子半径最小;T元素的价电子排布式为3d104s1。下列说法正确的是( )
A.简单离子的半径Y>Z>W
B.最高价氧化物对应水化物的酸性W>Z>X
C.W和T的单质混合加热可得化合物T2W
D.W的单质在足量的氧气中燃烧,所得产物溶于水可得强酸
难度: 中等查看答案及解析
-
下列实验中,能达到相应实验目的的是

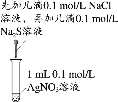
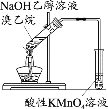
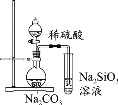
A.制备并收集乙酸乙酯
B.证明氯化银溶解度大于硫化银
C.验证溴乙烷的消去产物是乙烯
D.推断S、C、Si的非金属性强弱
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
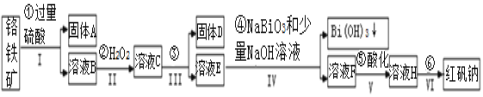
高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:其中除杂过程包括:①向浸出液中加入一定量的X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是( )
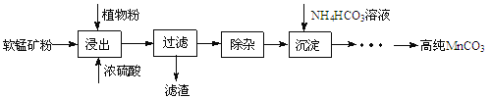
A.试剂X可以是MnO、MnO2、MnCO3等物质
B.浸出时加入植物粉的作用是作为还原剂
C.除杂过程中调节浸出液的pH为3.5~5.5可完全除去Fe、Al、Mg等杂质
D.为提高沉淀MnCO3步骤的速率可以持续升高温度
难度: 困难查看答案及解析
-
向某容积为2L的恒容密闭容器中充入2molX(g)和1molY(g),发生反应2X(g)+Y(g)
3Z(g)。反应过程中,持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
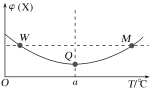
A.M点时,Y的转化率最大
B.平衡后充入X,达到新平衡时X的体积分数减小
C.升高温度,平衡常数减小
D.W、M两点Y的正反应速率相同
难度: 困难查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是( )
选项
实验操作和现象
结论
A
向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊
蛋白质可能发生了变性
B
将乙醇与浓硫酸混合加热,产生的气体通入酸性KMnO4溶液,溶液紫红色褪去
产生的气体中一定含有乙烯
C
室温下,用pH试纸测得:0.1 mol•L﹣1Na2SO3溶液的pH约为10;0.1 mol•L﹣1NaHSO3溶液的pH约为5
HSO3﹣结合H+的能力比SO32﹣的强
D
向NaCl和NaBr的混合溶液中滴入少量AgNO3溶液,产生淡黄色沉淀(AgBr)
Ksp(AgBr)<Ksp(AgCl)
A.A B.B C.C D.D
难度: 中等查看答案及解析
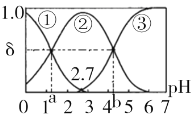
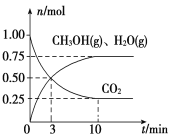
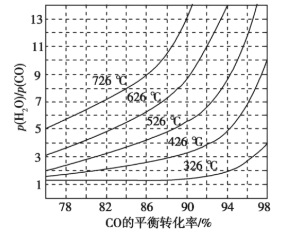
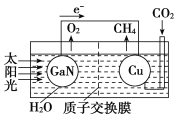
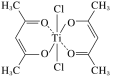
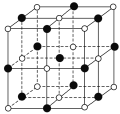
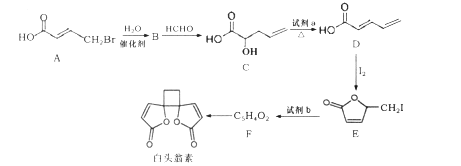
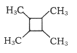 的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。