-
“低碳经济”已成为全世界科学家研究的重要课题。为减小和消除 CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对 CO2 创新利用的研究。
(1)已知:①CO(g)+H2O(g) H2(g)+CO2(g) △H=-41kJ/mol
H2(g)+CO2(g) △H=-41kJ/mol
②C(s)+2H2(g) CH4(g) △H=-73kJ/mol
CH4(g) △H=-73kJ/mol
③2CO(g) C(s)+CO2(g) △H=-17kJ/mol
C(s)+CO2(g) △H=-17kJ/mol
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:_____。
(2)目前工业上有一种方法是用 CO2来生产燃料甲醇。为探究该反应原理,在容积为 2L密闭容器中,充入1molCO2和 3.25molH2在一定条件下发生反应,测得 CO2、CH3OH(g)和 H2O(g)的物质的量(n)随时间的变化如图所示:
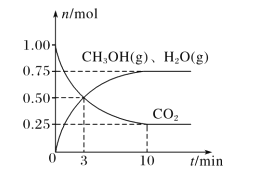
①从反应开始到平衡,氢气的平均反应速率v(H2)= ____。
②下列措施一定不能使CO2的平衡转化率增大的是____ (填字母)。
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)⇌H2(g)+CO2(g)的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
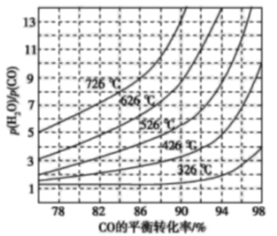
①上述反应的正反应方向是 ____(填“吸热”或“放热”)反应;
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作 Kp),则在恒温密闭容器中,该反应的Kp与Kc的关系是 _______,如果提高p(H2O)/p(CO),则Kp_______ (填“变大”“变小”或“不变”);使用铁镁催化剂的实际工业流程中,一般采用400℃左右,p(H2O)/p(CO) =3~5,采取此条件的原因可能是 _________ 。
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述正确的是 ____(填字母)。
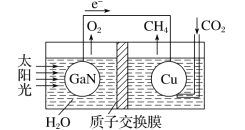
A.该装置能量转化形式仅存在太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.反应结束后,理论上溶液的 pH 值保持不变
-
“低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)已知:①CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
②C(s)+2H2(g)  CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③2CO(g)  C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:____
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2 L密闭容器中,充入1 mol CO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=________。
②下列措施一定不能使CO2的平衡转化率增大的是________。
A 在原容器中再充入1 mol CO2
B 在原容器中再充入1 mol H2
C 在原容器中充入1 mol氦气
D 使用更有效的催化剂
E 缩小容器的容积
F 将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)  H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
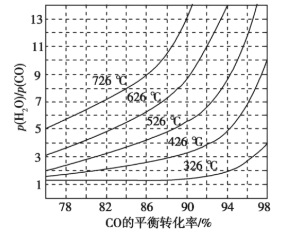
①上述反应的正反应方向是________反应(填“吸热”或“放热”);
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=_____(填表达式,不必代数计算);如果提高p(H2O)/p(CO),则Kp_______(填“变大”“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、p(H2O)/p(CO)=3~5,采用此条件的原因可能是_______
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述错误的是________。
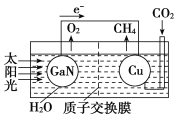
A.该装置能量转化形式仅存在将太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+===CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
-
(13分)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
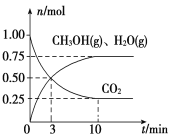
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1moleO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________
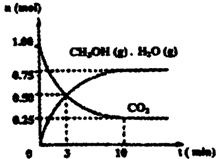
②下列措施中一定不能使CO2的转化率增大的是______________。
A.在原容器中再充入lmolCO2
B.在原容器中再充入1molH2
C.在原容器中充入lmol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3 
 +H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
+H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
(3)标准状况下,将4.48LCO2通入200mLl.5mol/L
的NaOH溶液,所得溶液中离子浓度由大到小的顺序为
_______________。
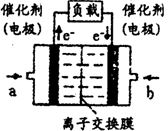
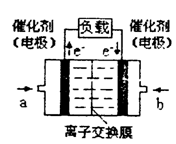
(4)如图是甲醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是___________(填“甲醇”或“氧气”),其电极上发生的电极反应式为____________。
(5)已知,常温下Ksp(AgCl)=2.0×10-10,Ksp(AgBr)=5.4×10-13.向BaBr2溶液中加入AgNO3和KCl,当两种沉淀共存时,溶液中c(Br-)和c(Cl-)的比值为____________。
-
(14分)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1mol CO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
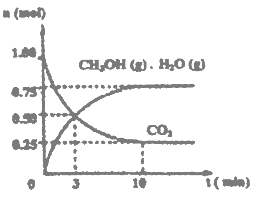
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________
②下列措施中一定不能使CO2的转化率增大的是______________。
A.在原容器中再充入lmolCO2
B.在原容器中再充入1molH2
C.在原容器中充入lmol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3 
 +H+的电离平衡常数 K=____________。(已知:10-5.6=2.5×10-6)。
+H+的电离平衡常数 K=____________。(已知:10-5.6=2.5×10-6)。
(3)标准状况下,将4.48LCO2通入200mLl.5mol/L的NaOH溶液,所得溶液中离子浓度由大到小的顺序为_______________。
(4)如图是甲醇燃料电池(电解质溶液为H2SO4溶液)的
结构示意图,则a处通入的是___________(填“甲醇”
或“氧气”),其电极上发生的电极反应式为____________。
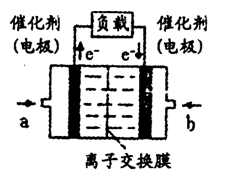
(5)已知,常温下Ksp(AgCl)=2.0×10-10,Ksp(AgBr)=5.4×10-13.向BaBr2溶液中加入AgNO3和KCl,当两种沉淀共存时,溶液中c(Br-)和c(Cl-)的比值为____________。
-
如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
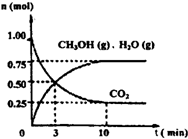
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=______.
②下列措施中一定不能使CO2的转化率增大的是______.
A.在原容器中再充入1molCO2 B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气 D.使用更有效的催化剂
E.缩小容器的容积 F.将水蒸气从体系中分离
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol/L.若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的电离平衡常数K=______.(已知:10-5.6=2.5×10-6).
HCO3-+H+的电离平衡常数K=______.(已知:10-5.6=2.5×10-6).
(3)标准状况下,将4.48LCO2通入200mL1.5mol/L的NaOH溶液,所得溶液中离子浓度由大到小的顺序为______.
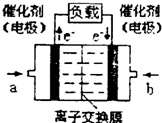
(4)如图是甲醇燃料电池(电解质溶液为KOH溶液)的
结构示意图,则a处通入的是______(填“甲醇”或
“氧气”),其电极上发生的电极反应式为______.
(5)已知,常温下Ksp(AgCl)=2.0×10-10,Ksp(AgBr)=5.4×10-13.向AgNO3溶液中加入KBr和KCl,当两种沉淀共存时,溶液中c(Br-)和c(Cl-)的比值为______.
-
如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
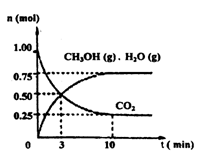
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=__________________________.
②下列措施中一定不能使CO2的转化率增大的是________________。
A.在原容器中再充入1molCO2 B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气 D.使用更有效的催化剂
E.缩小容器的容积 F.将水蒸气从体系中分离
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3
 +H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
+H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
(3)标准状况下,将4.48LCO2通入200mL1.5mol/L的NaOH溶液,所得溶液中离子浓度由大到小的顺序为_____________。
(4)如图是甲醇燃料电池(电解质溶液为KOH溶液)的
结构示意图,则a处通入的是_________(填“甲醇”或
“氧气”),其电极上发生的电极反应式为_____________。
(5)已知,常温下Ksp(AgCl)=2.0×10-10,Ksp(AgBr)=5.4×10-13. 向BaCl2溶液中加入AgNO3和KCl,当两种沉淀共存时,溶液中c(Br-)和c(Cl-)的比值为___________。
-
为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.“绿色自由”构想技术流程如下:
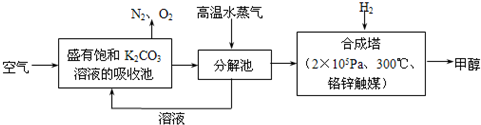
(1)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式是________.
(2)以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳.该电池负极发生的反应是:
CH3OH+H2O-6e-═CO2+6H+
则正极发生的反应是________;放电时,H+移向电池的________(填“正”或“负”)极.
(3)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol•L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3⇌HCO3-+H+的平衡常数K=________.(已知:10-5.6=2.5×10-6)
(4)常温下,0.1mol•L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)________c(CO32-) (填“>”、“=”或“<”),原因是________(用离子方程式和必要的文字说明).
(5)小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9.小李应该选用的试剂是________.
-
(15分)为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
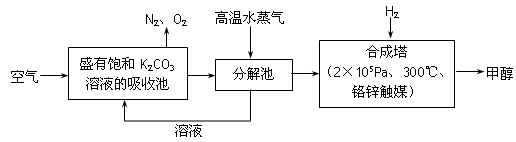
(1)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947 kJ的热量,试写出合成塔中发生反应的热化学方程式是________。
(2)以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:
CH3OH + H2O - 6e- ==== CO2 + 6H+
则正极发生的反应是________;放电时,H+移向电池的________(填“正”或“负”)极。
(3)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+ 的平衡常数K =________。(已知:10-5.6=2.5×10-6)
HCO3-+H+ 的平衡常数K =________。(已知:10-5.6=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)________c(CO32-) (填“>”、“=”或“<”),原因是________(用离子方程式和必要的文字说明)。
(5)小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。小李应该选用的试剂是___________________。
-
《巴黎协定》所倡导的是全球绿色、低碳。如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如图14 甲所示,总反应的化学方程式为_________________________________。
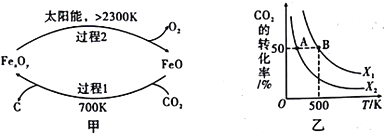
(2)CO2经催化加氢可合成低碳烯烃,合成乙烯的反应为2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) ΔH。
向1L恒容密闭容器中充入2mol CO2(g)和n mol H2(g),在一定条件下发生该反应。CO2的转化率与温
度、投料比[x= ]的关系如图乙所示。
]的关系如图乙所示。
①该反应的ΔH__________0(填“>”、“<”或“=”)。
②为提高CO2的平衡转化率,除改变温度外,还可采取的措施是____________(写1条即可)。
③图中X1_________X2(填“<”“>”.或“=”,下同)。
④若图乙中B点的投料比为2,则500℃时的平衡常数K(B)=_________________。
(3)工业上用CO2生产甲醇燃料,进一步可合成二甲醚。已知:298K和101kPa条件下,
CO2(g)+3H2(g) CH3OH(g)+H2O(l) △H=-akJ•mol-1
CH3OH(g)+H2O(l) △H=-akJ•mol-1
2H2(g)+O2(g)=2H2O(l) △H=-bkJ•mol-1
CH3OH(g)=CH3OH(l) △H=-ckJ•mol-1
①CH3OH(l)燃烧热的热化学方程式为________________________________。
②合成二甲醚的总反应为2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H=-130.8kJ•mol-1。一定条件下,该反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____________(填序号)。
CH3OCH3(g)+3H2O(g) △H=-130.8kJ•mol-1。一定条件下,该反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____________(填序号)。
a.逆反应速率先增大后减小 b.H2的转化率增大 c.反应物的体积百分含量减小
③在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6molCO2和12mol H2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=____________;KC、KD、KE三者之间的大小关系为___________________。
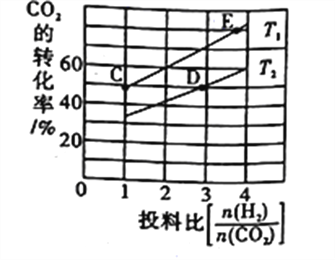
-
通常情况下空气中CO2的体积分数为0.030%,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作致冷剂已成为一种趋势,这一做法对环境的积极意义在于______.
(2)最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.“绿色自由”构想技术流程如下:
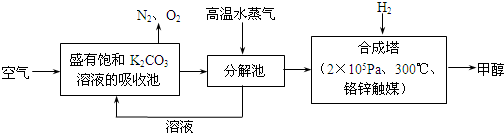
①分解池中反应的化学方程式为______ K2CO3+CO2↑+H2O
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1

H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:

















