-
为了防止FeSO4被氧化而变质,实验室在配制FeSO4溶液时,常在溶液中加入少量的( )
A.铜粉
B.铁粉
C.锌粉
D.Fe2(SO4)3难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.在任何条件下,1mol任何气体的体积都约是22.4L
B.化学的特征就是认识分子和制造分子
C.在化学反应中,反应物的物质的量之和一定等于生成物的物质的量之和
D.英国科学家道尔顿提出元素周期律,把化学元素及其化合物纳入一个统一的理论体系难度: 中等查看答案及解析
-
生活中难免会遇到一些突发事件,我们要善于利用学过的知识,采取科学、有效的方法保护自己.如果发生了氯气泄漏,以下自救方法得当的( )
A.只要在室内放一盆水
B.向地势低的地方撤离
C.观察风向,顺风撤离
D.用湿毛巾或蘸有肥皂水的毛巾捂住口鼻撤离难度: 中等查看答案及解析
-
关于钠的叙述中,正确的是( )
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上用酒精灯加热后,金属钠剧烈燃烧,产生黄色火焰,生成淡黄色固体
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高难度: 中等查看答案及解析
-
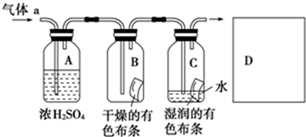
下列说法错误的是( )
A.钠和铁一样,都能在氯气中燃烧生成金属氯化物
B.液氯是氯气的水溶液,它能使干燥的有色布条褪色
C.氯气跟变价金属反应生成高价金属氯化物
D.氯水具有杀菌、漂白作用是因为氯水中含有强氧化性的次氯酸难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.直径介于1~10 nm之间的粒子称为胶体
B.Fe(OH)3胶体是纯净物
C.利用丁达尔效应可以区别溶液与胶体
D.胶体粒子不可以透过滤纸难度: 中等查看答案及解析
-
分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类以及依据正确的是( )
A.H2SO4是酸,因为H2SO4中含有氢元素
B.豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间
C.Na和H2O的反应不是离子反应,因为反应中没有离子参加
D.燃烧必须有氧气参与,因而没有氧气参与的反应一定没有燃烧现象难度: 中等查看答案及解析
-
下列是某同学对KHSO4的物质类型进行的分析,其中不正确的是( )
A.根据元素组成知它是化合物
B.因它含有钾与硫酸根,故KHSO4是钾盐
C.KHSO4可以称为硫酸盐
D.因为它含有与酸相同的元素氢,故KHSO4也可称为酸难度: 中等查看答案及解析
-
下列说法正确的是( )
A.NaHCO3的电离方程式为:NaHCO3=Na++H++CO32-
B.金属氧化物不一定是碱性氧化物
C.在碱性溶液中能大量共存的离子为:Fe3+、Na+、Cl-、SO42-
D.SO3溶于水,其水溶液能导电,SO3是电解质难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O
B.氢氧化钡溶液与盐酸反应:OH-+H+=H2O
C.硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH-=Cu(OH)2↓
D.钠投入水中:Na+H2O=Na++OH-+H2↑难度: 中等查看答案及解析
-
下列物质的体积一定是22.4L的是( )
A.标准状况下18g水
B.17g氨气
C.标准状况下44g二氧化碳
D.0℃、2×105Pa时2g氢气难度: 中等查看答案及解析
-
下列说法错误的是( )
A.从1L 1mol•L-1的氯化钠溶液中取出10ml,其浓度仍是1mol•L-1
B.物质的量是指物质所含微粒的数目
C.0.5L 2mol•L-1的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023
D.冰水混合物既是纯净物又是化合物难度: 中等查看答案及解析
-
下列溶液中的Cl-浓度与50mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
A.150mL 1mol•L-1 NaCl溶液
B.75mL 2mol•L-1 CaCl2溶液
C.150mL 2mol•L-1 KCl溶液
D.75mL 1mol•L-1 AlCl3溶液难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.NaCl溶液在电流的作用下电离为钠离子和氯离子
B.溶于水后能电离出氢离子的化合物都是酸
C.尽管BaSO4难溶于水,但它仍然是强电解质
D.二氧化碳溶于水后能部分电离,所以二氧化碳是弱电解质难度: 中等查看答案及解析
-
判断下列叙述正确的是( )
A.标准状况下,1mol任何物质的体积都约为22.4L
B.1mol任何气体所含分子数都相同,体积也都约为22.4L
C.在常温常压下金属从盐酸中置换出1molH2转移电子数为1.204×1024
D.在同温同压下,相同体积的任何气体单质所含原子数目相同难度: 中等查看答案及解析
-
氮化铝广泛应用于电子陶瓷等工业领域.在一定条件下,AlN可通过反应:Al2O3+N2+3C
2AlN+3CO合成.下列叙述正确的是( )
A.上述反应中,N2是氧化剂,被氧化
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮的化合价为+3
D.AlN的摩尔质量为41g难度: 中等查看答案及解析
-
常温下,在溶液中可以发生反应:X+2Y3+═X2++2Y2+,则下列解释:①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥Y3+的氧化性比X2+要强.其中正确的是( )
A.②④⑥
B.①③④
C.②⑤
D.①③⑤⑥难度: 中等查看答案及解析
-
向Fe2O3、CuO、Fe、Cu的混和粉末中加入过量的稀盐酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是( )
A.只有Fe2+和Cu2+
B.一定有Fe2+、Cu2+,可能有Fe3+
C.一定有Fe2+,可能有Cu2+
D.只有Fe2+难度: 中等查看答案及解析