-
下列反应中,既属于氧化还原反应同时又是吸热反应的是( )
A. Ba(OH)2•8H2O与NH4Cl反应 B. 灼热的碳与高温水蒸气的反应
C. 铝与稀盐酸 D. H2与O2的燃烧反应
难度: 简单查看答案及解析
-
下列关于反应与能量的说法正确的是
A. H2与Cl2反应生成HCl,在光照与点燃条件下,ΔH不同
B. 氢氧化钠与盐酸反应中,盐酸足量,则氢氧化钠越多,中和热越大
C. 已知1mol红磷转化为1mol白磷,需吸收18.39kJ的能量,则红磷比白磷稳定
D. 催化剂能加快反应速率,是因为它能减小反应的焓变
难度: 中等查看答案及解析
-
下列说法或表示方法正确的是( )
A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)=C(金刚石) ΔH= +1.9kJ·mol-1”可知,金刚石比石墨稳定
C.在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) ΔH= +285.8kJ·mol-1
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3kJ
难度: 简单查看答案及解析
-
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
A.v(W)=3v(Z) B.2v(X)=3v(Z) C.2v(X)=v(Y) D.3v(W)=2v(X)
难度: 简单查看答案及解析
-
已知吸热反应2CO(g)=2C(s)+O2(g),设ΔH和ΔS不随温度而变化,下列说法中正确的是( )
A.低温下能自发进行 B.高温下能自发进行
C.任何温度下都能自发进行 D.任何温度下都不能自发进行
难度: 简单查看答案及解析
-
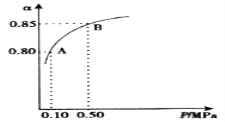
等质量的铁与过量的盐酸在不同的试验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到图甲,则曲线a、b、c、d所对应的试验组别是( )
组别
c(HCl)(mol·L-1)
温度(℃)
铁的状态
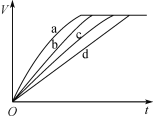
1
2.0
25
块状
2
2.5
30
块状
3
2.5
50
粉末状
4
2.5
30
粉末状
A.3-4-2-1 B.1-2-4-3 C.4-3-2-1 D.1-2-3-4
难度: 中等查看答案及解析
-
在某密闭容器中,可逆反应:A(g)+B(g)
xC(g)符合图像(Ⅰ)所示关系。由此推断,对图像(Ⅱ)的不正确的说法是( )
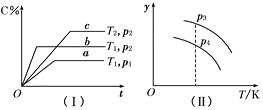
A.p3>p4,y轴表示A的转化率
B.p3>p4,y轴表示B的质量分数
C.p3>p4,y轴表示C的质量分数
D.p3>p4,y轴表示混合气体的平均相对分子质量
难度: 中等查看答案及解析
-
对于反应:4CO(g)+2NO2(g)
4CO2(g)+N2(g) △ H=-1200 kJ·mol-1,温度不同 (T2>T1),其他条件相同时,下列图像正确的是( )
A.
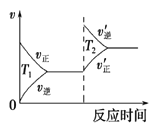 B.
B.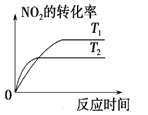 C.
C.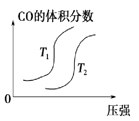 D.
D.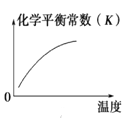
难度: 中等查看答案及解析
-
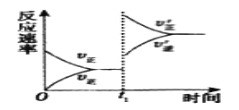
某恒容密闭容器中充入一定量SO2和O2进行反应:2SO2(g)+O2(g)
2SO3(g)ΔH<0,图甲表示反应速率(v)与温度(T)的关系、图乙表示T1时,平衡体系中SO2的体积分数与压强(p)的关系。下列说法不正确的是( )
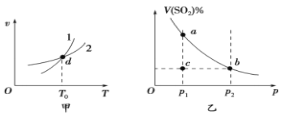
A.图甲中,曲线1表示逆反应速率与温度的关系
B.图甲中,d点时,混合气体的平均摩尔质量不再改变
C.图乙中,a、b两点的反应速率:va>vb
D.图乙中,c点的正、逆反应速率:v(逆)>v(正)
难度: 中等查看答案及解析
-
T℃时,将A和B各0.32mol充入恒容密闭容器中,发生反应:A(g)+B(g)
2C(g)△H=-akJ·mol-1(a>0),反应过程中测定的数据如下表,下列说法正确的是( )
t/min
0
2
4
7
9
n(B)/mol
0.32
0.24
0.22
0.20
0.20
A.若起始时向容器中充入0.64molC,则达平衡时吸收的热量为0.12akJ
B.恒温,如果压缩容器体积,B的浓度和体积分数均不变
C.若起始时向容器中充入0.64molA和0.64molB,则达平衡时n(C)<0.40mol
D.恒温、恒容,向平衡体系中再充入0.32molA,再次平衡时,B的转化率增大
难度: 中等查看答案及解析
-
己知 25°C,101 kPa 时,2SO2(g)+O2(g)
2SO3(g);△H=-197 kJ·mol-1。向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2、0.5 mol O2 达到平衡时放出热量为Q2,则下列关系正确的是
A.2Q2<Q1<197 kJ B.Q2=Q1=197 kJ C.Q1<Q2<197 kJ D.2Q2=Q1<197 kJ
难度: 中等查看答案及解析
-
少量铁粉与100mL0.01mol·L-1的稀盐酸反应,反应速率太慢,为了加快此反应速率而不改变H2的量,可以使用如下方法中的( )
①加H2O②加NaOH固体③滴入几滴浓盐酸④加CH3COONa固体⑤加NaCl溶液⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用10mL0.1mol·L-1盐酸
A.⑤⑦⑧ B.③⑤⑧ C.①⑥⑦ D.③⑦⑧
难度: 中等查看答案及解析
-
下列不能用勒夏特列原理解释的是
A. 新制氯水光照后颜色变浅
B. 2HI(g)
H2(g)+I2(g)平衡体系,加压颜色变深
C. 高压比常压有利于合成氨
D. 钠与氯化钾共融制备钾Na(1)+KCl(l)
K(g)+NaCl(l)
难度: 中等查看答案及解析
-
已知某化学反应的平衡常数表达式为K=[c(CO2)·c(H2)] /[c(CO)·c(H2O)],在不同的温度下该反应的平衡常数值分别为:
t/℃
700
800
830
1000
1200
K
1.67
1.11
1.00
0.60
0.38
下列有关叙述错误的是
A. 该反应的化学方程式是:CO(g)+H2O(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 如果在1L的密闭容器中加入CO2和H2各1mol,再把温度升高到830℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
D. 若平衡浓度关系符合c(CO2)/3c(CO)=c(H2O)/5c(H2),可判断此时温度是1000℃
难度: 中等查看答案及解析
-
在密闭容器中一定量混合气体发生反应:2A(g)+B(g)
xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是
A. x=3 B. 平衡向正反应方向移动
C. B的转化率降低 D. C的体积分数增大
难度: 困难查看答案及解析
-
如图是温度和压强对X+Y
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
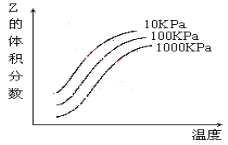
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的逆反应的△H>0
难度: 中等查看答案及解析
-
如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)
xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
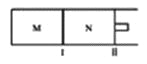
A.若x=3,达到平衡后A的体积分数关系为:
B.若x<3,C的平衡浓度关系为:c(M)<c(N)
C.若x>3,达到平衡后B的转化率关系为:
D.x不论为何值,平衡时M、N中的平均相对分子质量都相等
难度: 中等查看答案及解析