-
化学与人类生活、社会可持续发展密切相关,下列说法错误的是
A.高级脂肪酸乙酯是生物柴油的一种成分,它属于油脂
B.葡萄中含有的花青素在碱性环境下显蓝色,可用苏打粉检验假葡萄酒
C.2020年北京冬奥会速滑服主要材料是聚氨酯,属于有机高分子化合物
D.采煤工业爆破时把干冰和炸药放在一起,既能增强爆炸威力,又能预防火灾
难度: 简单查看答案及解析
-
运用现代科技从苦艾精油中分离出多种化合物,其中四种的结构如下:
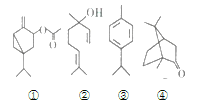
下列说法不正确的是( )
A.②③分子中所有碳原子不可能处于同一平面内
B.②④互为同分异构体
C.④的一氯代物有6种
D.①②③均能使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
我国科研人员研究了在Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+* H)。下列说法错误的是
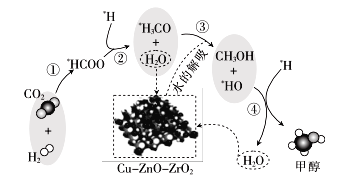
A.向该反应体系中加入少量的水能增加甲醇的收率
B.带*标记的物质是该反应历程中的中间产物或过渡态
C.二氧化碳加氢制甲醇的过程中原子利用率达100%
D.第③步的反应式为*H3CO+ H2O→CH3OH+*HO
难度: 简单查看答案及解析
-
乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略) 如图所示。下列说法错误的是
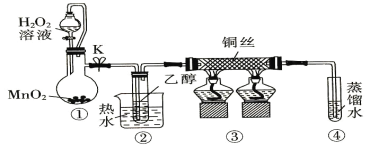
A.①中用胶管连接其作用是平衡气压,便于液体顺利流下
B.实验过程中铜丝会出现红黑交替变化
C.实验开始时需先加热②,再通O2,然后加热③
D.实验结束时需先将④中的导管移出,再停止加热。
难度: 中等查看答案及解析
-
W、X、Y、Z、R是短周期原子序数依次增大的主族元素,X原子最外层电子数是电子层数的2倍,Z为地壳中含量最高的元素,R的单质是短周期最活泼的金属。由W、X、Y三种元素组成的化合物甲的球棍模型如图,甲是运载火箭的燃料之一。下列说法正确的是
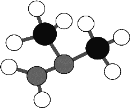
A.化合物甲分子中每个原子都达8电子的稳定结构
B.W、Y、Z三种元素可形成离子化合物
C.Y与Z只能形成2种二元化合物
D.简单离子半径:R > Z > Y
难度: 中等查看答案及解析
-
最近一个科学硏究小组创建了一种通过连续电解将能量储存为化学能的装置。在氧化钇基质的阳极和二氧化钛涂覆的钛阴极之间是可通过H+的固体聚合物电解质。其结构如图所示,则下列说法错误的是
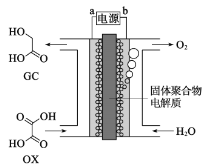
A.电源的b极为正极
B.在能量转换过程中,固体电解质中H+由图中电池右侧向左侧移动
C.阴极电极反应式为:OX+4H++4e-=GC+H2O
D.为增强阳极电解液导电性,可在水中添加适量盐酸或NaCl
难度: 中等查看答案及解析
-
常温下,用0.10 mol/L NaOH溶液分别滴定20.00 mL浓度均为0.10 mol/LCH3COOH溶液和 HCN 溶液所得滴定曲线如图[Ka(CH3COOH)>Ka(HCN)]。下列说法正确的是
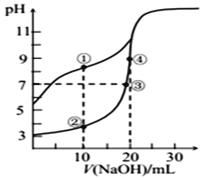
A.点①和点②所示溶液中:c(CH3COO﹣)<c(CN﹣)
B.点①和点②所示溶液中:c(CH3COO﹣)-c(CN﹣) = c(HCN)-c(CH3COOH)
C.溶液中水的电离程度:③>④
D.点③和点④所示溶液中都有:c(CH3COO﹣)+c(OH﹣) = c(CH3COOH)+c(H+)
难度: 困难查看答案及解析

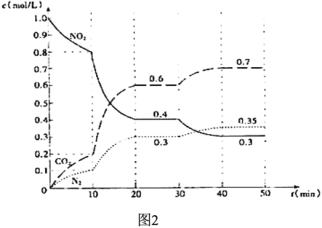
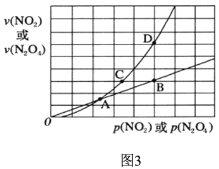
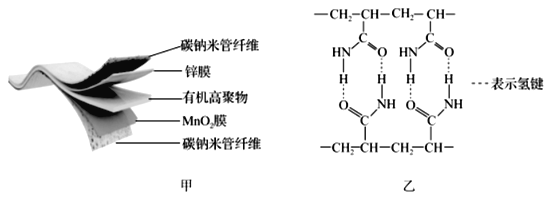
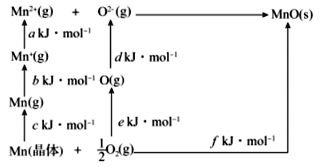
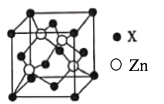
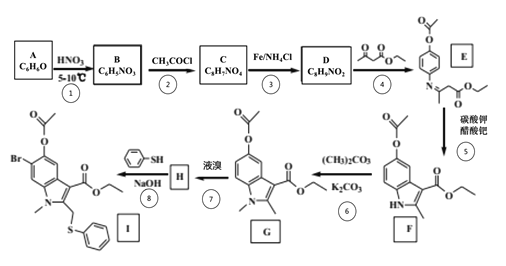
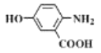 的合成路线(无机试剂任用)__________________。
的合成路线(无机试剂任用)__________________。