-
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。回答下列问题:
(1)已知:2NO2(g)= N2O4(g) △H=-55.3kJ/mol
N2O5(g)=2NO2(g)+ O2(g) △H=+53.1 kJ/mol
O2(g) △H=+53.1 kJ/mol
则:N2O5(g)=N2O4(g)+ O2(g) △H=___________ kJ/mol
O2(g) △H=___________ kJ/mol
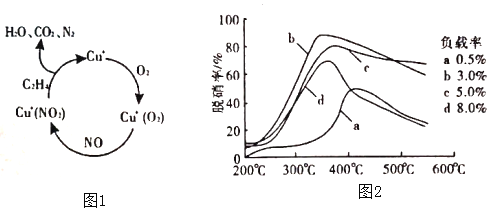
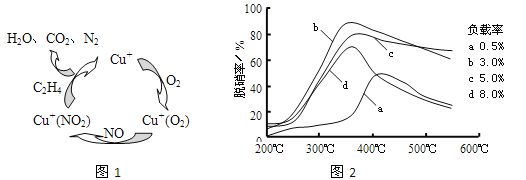
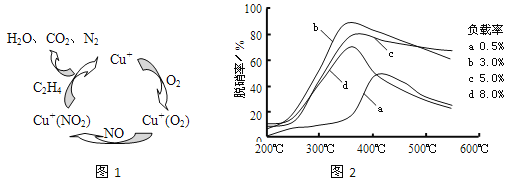
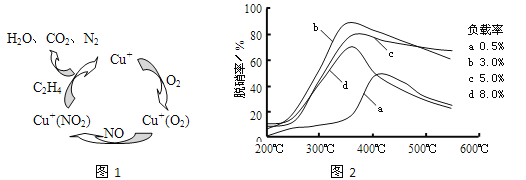
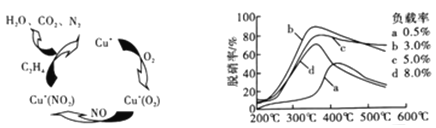
(2)以乙烯(C2H4)作为还原剂脱硝(NO),脱硝机理如图1。若反应中n(NO)︰n(O2)=2︰1,则总反应的化学方程式为___________;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2,为达到最佳脱硝效果,应采用的条件是___________。
(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g) 2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:

①从0~2s内该反应的平均速率υ(NO)=___________mol/(L·s)。
②T1温度时化学平衡常数K=___________ L/mol。 (结果保留3位有效数字)。
③化学平衡常数K与速率常数k正、k逆的数学关系是K=___________。若将容器的温度改变为T2时其k正=k逆,则T2___________T1(填“>”、“<”或“=")。
④已知2NO(g)+O2(g) 2NO2的反应历程为:
2NO2的反应历程为:
第一步NO+NO N2O2 快速反应 第二步N2O2+O2→2NO2 慢反应
N2O2 快速反应 第二步N2O2+O2→2NO2 慢反应
下列叙述正确的是___________(填标号)。
A. υ(第一步的正反应)< υ(第二步的反应) B.总反应快慢由第二步决定
C.第二步的活化能比第一步的高 D.第二步中N2O2与O2的碰撞100%有效
-
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO(g) +O2(g) -2NO2(g) △H的反应历程分两步:
-2NO2(g) △H的反应历程分两步:
①2NO( g ) N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2 (g)+ O2 (g)  2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)•c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)•c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小: E1__ E2 (填“>”、“<”或“=”) 其判断理由是__________;2NO(g) +O2(g) 2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)
2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)  2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
(2)①以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如左下图所示,若反应中n(NO): n(O2) =2 :1,则总反应的化学方程式为_______________;脱硝率与温度、负载率(分子筛中催化剂的质量分数) 的关系如右下图,为达到最佳脱硝效果,应采用的条件是________________。
②用NO可直接催化NO分解生成N2、O2,将其反应机理补充完整(Vo代表氧空穴):
2Ni2++2Vo+2NO→2Ni3++2O-+N2 2O-→O2-+1/2O2+Vo ______________
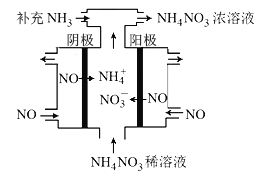
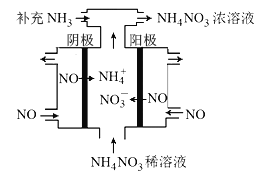
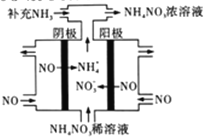
(3)电解NO可制备NH4NO3,其工作原理如图所示,阴极的电极反应式为______________。
-
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO(g) +O2(g) -2NO2(g) △H的反应历程分两步:
-2NO2(g) △H的反应历程分两步:
①2NO( g ) N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2 (g)+ O2 (g)  2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)•c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)•c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小: E1__ E2 (填“>”、“<”或“=”) 其判断理由是__________;2NO(g) +O2(g) 2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)
2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)  2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
(2)①以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如左下图所示,若反应中n(NO): n(O2) =2 :1,则总反应的化学方程式为_______________;脱硝率与温度、负载率(分子筛中催化剂的质量分数) 的关系如右下图,为达到最佳脱硝效果,应采用的条件是________________。
②用NO可直接催化NO分解生成N2、O2,将其反应机理补充完整(Vo代表氧空穴):
2Ni2++2Vo+2NO→2Ni3++2O-+N2 2O-→O2-+1/2O2+Vo ______________
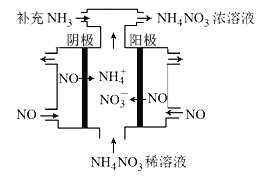
(3)电解NO可制备NH4NO3,其工作原理如图所示,阴极的电极反应式为______________。
-
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO(g) +O2(g) -2NO2(g) △H的反应历程分两步:
-2NO2(g) △H的反应历程分两步:
①2NO( g ) N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2 (g)+ O2 (g)  2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)•c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)•c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小: E1__ E2 (填“>”、“<”或“=”) 其判断理由是__________;2NO(g) +O2(g) 2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)
2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)  2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
(2)①以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如左下图所示,若反应中n(NO): n(O2) =2 :1,则总反应的化学方程式为_______________;脱硝率与温度、负载率(分子筛中催化剂的质量分数) 的关系如右下图,为达到最佳脱硝效果,应采用的条件是________________。
②用NO可直接催化NO分解生成N2、O2,将其反应机理补充完整(Vo代表氧空穴):
2Ni2++2Vo+2NO→2Ni3++2O-+N2 2O-→O2-+1/2O2+Vo ______________
(3)电解NO可制备NH4NO3,其工作原理如图所示,阴极的电极反应式为______________。
-
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。请回答下列问题:
(1)已知:H2的燃烧热△H为-285.8kJ/mol。
N2(g)+2O2(g)=2NO2(g) △H=+133 kJ/mol
H2O(g)=H2O(1) △H=-44 kJ/mol
则H2和NO2反应生成两种无污染的气体的热化学反应方程式为______________________。
(2)一定温度下,向2L恒容密闭容器中充入0.40molN2O4,发生反应:N2O4(g) 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
| 时间/s | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①0~40s内,v(NO2)=___________。
②升高温度时,气体颜色加深,则上述反应是___________(填“放热”或“吸热”)反应。
③该温度下反应的化学平衡常数K=___________。
④相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后c(NO2)___________(填“>”=”或”<”)0.60mol/L
(3)已知2NO(g)+O2(g) 2NO2(g) △H的反应历程分两步:
2NO2(g) △H的反应历程分两步:
①2NO(g) N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
②N2O2(g)+O2(g) 2NO2(g)(慢) △H2<O,v2正=k2正c (N2O2)·c(O2),v2逆=k2逆c 2(NO2)
2NO2(g)(慢) △H2<O,v2正=k2正c (N2O2)·c(O2),v2逆=k2逆c 2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小:E1___________E2(填“>”“<”或“=”),其判断理由是____________________;2NO(g)+O2(g) 2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为______________________。
2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为______________________。
(4)N2O5是绿色硝化试剂,溶于水可得硝酸。下图是以N2O4为原料电解制备N2O的装置。写出阳极区生成N2O5的电极反应式(注意阳极区为无水环境,HNO3亦无法电离): _________________________________。

-
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO(g)+O2(g) -2NO2(g)△H的反应历程分两步:
-2NO2(g)△H的反应历程分两步:
①2NO(g) N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2(g)+ O2(g)  2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)•c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)•c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小: E1__ E2 (填“>”、“<”或“=”) 其判断理由是__________;2NO(g)+O2(g) 2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)
2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)  2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
(2)①以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如左下图所示,若反应中n(NO):n(O2) =2:1,则总反应的化学方程式为_______________;脱硝率与温度、负载率(分子筛中催化剂的质量分数) 的关系如右下图,为达到最佳脱硝效果,应采用的条件是________________。
②用NO可直接催化NO分解生成N2、O2,将其反应机理补充完整(Vo代表氧空穴):
2Ni2++2Vo+2NO→2Ni3++2O-+N2 2O-→+O2-+1/2O2+V。______________
(3)电解NO可制备NH4NO3,其工作原理如右图所示,阴极的电极反应式为______________。
-
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
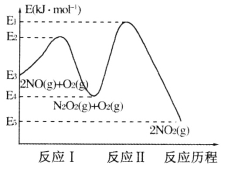
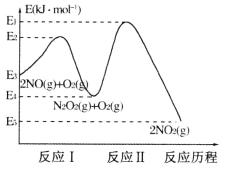
(1)NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
回答下列问题:
①写出反应I的热化学方程式_________。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
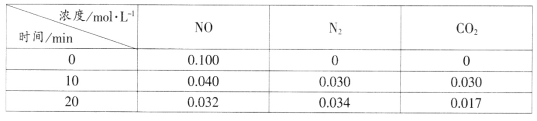
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
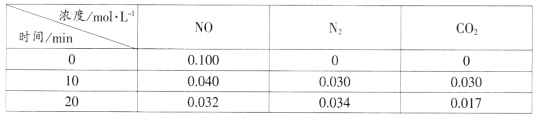
①T℃时,该反应的平衡常数为_____________________(保留两位有效数字)。
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是__________________________________。
③在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正_______v逆(填“>”、“<”或“=”)。
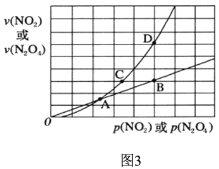
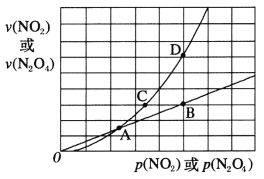
(3)NO2存在如下平衡:2NO2(g) N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
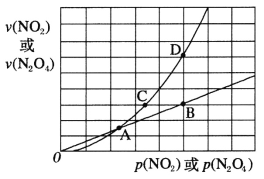
一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的点是___,理由是________。
-
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
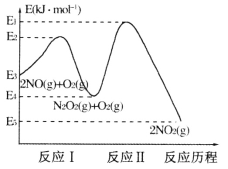
回答下列问题:
①写出反应I的热化学方程式_________。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
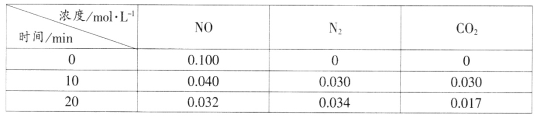
①T℃时,该反应的平衡常数为_____________________(保留两位有效数字)。
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是__________________________________。
③在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正_______v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g) N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
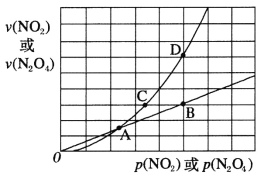
一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的点是___,理由是________。
-
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
回答下列问题:
①写出反应I的热化学方程式_________。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
①T℃时,该反应的平衡常数为_____________________(保留两位有效数字)。
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是__________________________________。
③在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正_______v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g) N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的点是___,理由是________。
-
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
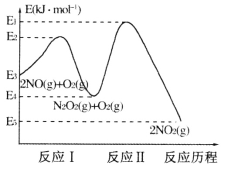
(1)NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
回答下列问题:
①写出反应I的热化学方程式_________。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
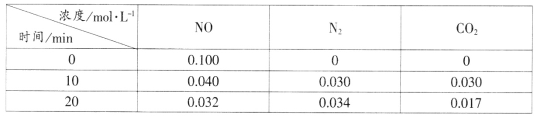
①T℃时,该反应的平衡常数为_____________________(保留两位有效数字)。
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是__________________________________。
③在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正_______v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g) N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
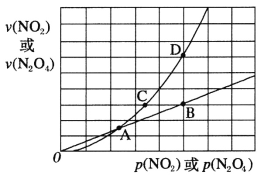
一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的点是___,理由是________。
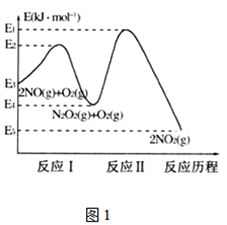
2NO2(g)反应速率的是___(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是_____________(反应未使用催化剂)。
N2(g)+2CO2(g),起始时向密闭容器中充入一定量的C(s)和NO2(g),在不同条件下,测得各物质的浓度变化状况如下图所示。
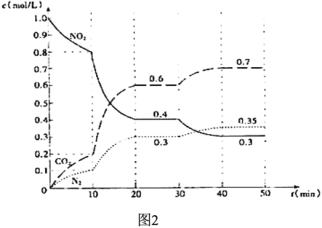
N2O4(g)△H<0,在图3标出点中,指出能表示反应达到平衡状态的点是________,理由是________________。