-
下列反应不属于可逆反应的是
A.二氧化硫的催化氧化
B.氯气溶于水
C.工业合成氨
D.水电解生成H2和O2与H2在O2中的燃烧反应
难度: 简单查看答案及解析
-
下列物质间的反应,其能量变化符合如图的是
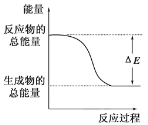
A.碳酸钙的分解 B.碳和水蒸气制取水煤气(CO、H2)
C.铁生锈 D.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
难度: 简单查看答案及解析
-
下列化学用语或模型图表示正确的是
A.S2−的结构示意图为:
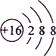
B.CO2分子比例模型:
C.6个质子8个中子的碳元素的核素符号:12C
D.NH4Cl的电子式:
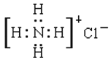
难度: 简单查看答案及解析
-
在2A+B⇌3C+4D反应中,表示该反应速率最快的是
A.v(A)=15mol·(L·min)−1 B.v(B)=18mol·(L·min)−1
C.v(C)=0.8mol·(L·s)−1 D.v(D)=1mol·(L·s)−1
难度: 中等查看答案及解析
-
根据化学变化的实质是旧的化学键断裂、新的化学键形成这一理论,判断下列变化是化学变化的是
A.固体氯化钠溶于水 B.二氧化氮溶于水
C.冰经加热变成水蒸气 D.氯化氢溶于水
难度: 简单查看答案及解析
-
下列叙述正确的是
A.40K与40Ca有相同的中子数 B.H2与D2互为同位素
C.S2与S8是同素异形体 D.16O3的摩尔质量是48
难度: 简单查看答案及解析
-
下列有关电池的说法不正确的是
A.手机上用的锂离子电池属于二次电池
B.铅蓄电池是可充电电池,电池的正极材料为PbO2
C.燃料电池是一种高效且对环境友好的新型电池
D.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
难度: 简单查看答案及解析
-
1999年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素,该同位素原子的质量数为298。以下叙述不正确的是
A.该元素属于第七周期 B.该元素为金属元素,性质与82Pb相似
C.该元素位于ⅣA族 D.该同位素原子含有184个质子
难度: 简单查看答案及解析
-
下列说法不正确的是
A.和酸反应时Zn能失2e−,Na失e−,所以Zn的金属性强于Na
B.金属性:Rb>K>Na>Li
C.在钠、钾、铷三种单质中,铷的熔点最低
D.硝酸铷是离子化合物,易溶于水
难度: 中等查看答案及解析
-
离子RO4n-中共有x个核外电子,R原子的质量数为A,则R原子核内含中子的数目
A.A+n+32-x B.A+n-24-x C.A-n+24-x D.A+n+24-x
难度: 简单查看答案及解析
-
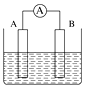
下列关于图所示原电池装置的叙述中,正确的是
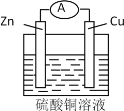
A.铜片是正极,电极上发生氧化反应
B.铜片质量逐渐增加
C.电流从锌片经导线流向铜片
D.铜片上的电极反应式为:Cu2+-2e−=Cu
难度: 中等查看答案及解析
-
同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是:HAO4>H2BO4>H3CO4,则下列判断错误的是
A.阴离子还原性C3−>B2−>A− B.气态氢化物稳定性HA>H2B>CH3
C.非金属性A>B>C D.离子半径A>B>C
难度: 中等查看答案及解析
-
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd+2NiO(OH)+2H2O
Cd(OH)2+2Ni(OH)2;由此可知,该电池放电时的负极材料是
A.Cd B.Ni(OH)2 C.Cd(OH)2 D.NiO(OH)
难度: 简单查看答案及解析
-
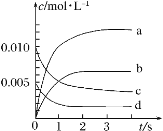
将4mol A气体和2mol B气体置于1L的密闭容器中,混合后发生如下反应:2A(g)+B(g)=2C(g)+D(s)。若经2s后测得C的浓度为1.8mol/L,下列说法正确的是
A.2s时物质A的浓度为0.9mol/L
B.用物质D表示的反应速率为0.45mol/(L·s)
C.用物质A表示的反应速率为1.8mol/(L·s)
D.2s时物质B的浓度为1.1mol/L
难度: 中等查看答案及解析
-
一定温度下在密闭容器中,a mol SO2和b mol O2发生反应,达平衡时有c mol SO3生成,则在平衡混合气体中SO2所占的体积分数为
A.
B.
C.
D.
难度: 中等查看答案及解析
-
应用元素周期律的有关知识,可以预测我们不熟悉的一些元素的单质及其化合物的性质。下列预测中正确的是
①第2周期非金属元素的气态氢化物溶于水后,水溶液可能为碱性
②砹(At)单质为有色固体,AgAt不溶于水,也不溶于稀硝酸
③Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
④硫酸锶(SrSO4)是难溶于水的白色固体
⑤硒化氢(H2Se)是无色、有毒、比H2S稳定的气体
A.②④ B.①②④ C.①③⑤ D.②④⑤
难度: 中等查看答案及解析
-
在密闭容器中进行反应X+3Y⇌2Z,已知反应中X、Y、Z的起始浓度分别为0.1mol/L、0.4mol/L、0.2mol/L,在一定条件下,当反应达到化学平衡时,各物质的浓度可能是
A.X为0.2mol/L B.Y为0.45mol/L
C.Z为0.5mol/L D.Y为0.1mol/L
难度: 中等查看答案及解析
-
由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
甲
乙
丙
装置
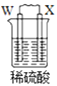
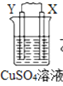
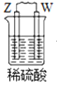
现象
金属W不断溶解
Y 的质量增加
W上有气体产生
A.四种金属的活动性强弱顺序为Z>W>Y>X
B.装置乙中Y电极上的反应式为Cu2++2e−=Cu
C.装置甲中X作原电池正极
D.装置丙中溶液的c(H+)减小
难度: 中等查看答案及解析
-
下列说法正确的是
A.同一周期相邻主族的两种元素的原子序数之差一定是1
B.同一主族的两种元素的原子序数之差可能是36
C.同一主族相邻周期的两种元素的原子序数之差可能是26
D.同一主族相邻周期的两种元素的原子序数之差都相同
难度: 中等查看答案及解析
-
下列说法正确的是
A.煤、石油、天然气是当今世界最重要的三种化石燃料
B.CaO+H2O=Ca(OH)2可放出大量热,可利用该反应设计成原电池,把化学能转化为电能
C.决定化学反应速率的主要因素为反应温度
D.人体运动所消耗的能量与化学反应无关
难度: 简单查看答案及解析
-
氢化钠(NaH)化合物中钠元素是+1价,NaH跟水反应放出H2,下列叙述正确的是
A.在NaH中的氢离子半径比锂离子半径小
B.NaH跟水反应后溶液呈酸性
C.在NaH中氢离子的电子层排布与Li+相同
D.NaH中的氢离子被还原成氢气
难度: 中等查看答案及解析
-
X、Y、Z、M、Q、R皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是
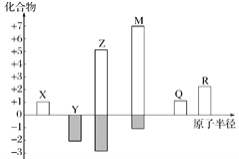
A.Q位于第三周期ⅠA族
B.Z与M的氧化物对应水化物均为强酸
C.简单离子半径:M−>R2+>Q+
D.X、Y、Z三种元素组成的化合物可能含有离子键和共价键
难度: 中等查看答案及解析
-
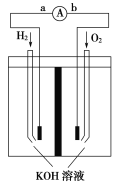
燃料电池是燃料(如氢气、甲烷(CH4)、一氧化碳等)跟氧气(或空气)起反应将化学能转变为电能的装置,电解质溶液是KOH溶液。电池的总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,下面关于甲烷燃料电池的说法不正确的是
A.正极反应式:O2+4H++4e−=2H2O
B.负极反应式:CH4+10OH−-8e−=CO32-+7H2O
C.随着放电的进行,溶液中氢氧根离子的浓度变小
D.放电时溶液中的阳离子向正极移动
难度: 中等查看答案及解析
-
在两个恒温、恒容的密闭容器中进行下列两个可逆反应:(甲)2X(g)⇌Y(g)+Z(s);(乙)A(s)+2B(g)⇌C(g)+D(g),当下列物理量不再发生变化时:①混合气体的密度;②混合气体的压强;③反应物的消耗速率与生成物的消耗速率之比等于系数之比;④反应容器中生成物的百分含量;⑤混合气体的总物质的量。其中能表明(甲)和(乙)都达到化学平衡状态是
A.①②③ B.①②③④ C.①③④ D.①②③④⑤
难度: 中等查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物的摩尔质量为17g/mol;W的质子数是X、Y、Z、M四种元素质子数之和的
。下列说法正确的是
A.XZ2、M2Z2均为共价化合物
B.原子半径:W>Z>Y>X>M
C.由X元素形成的单质硬度一定很大
D.由X、Y、Z、M四种元素形成的化合物只含有离子键
难度: 中等查看答案及解析