-
必须随配随用,不能长期存放的试剂是()
A.氢硫酸 B.盐酸 C.AgNO3溶液 D.NaOH溶液
难度: 简单查看答案及解析
-
能用元素周期律解释的是( )
A.酸性: H2SO3>H2CO3 B.熔、沸点:HF>HCl
C.碱性: NaOH>Al(OH)3 D.热稳定性: Na2CO3>CaCO3
难度: 简单查看答案及解析
-
用氯气和绿矾处理水,下列说法错误的是( )
A.氯气起杀菌消毒作用
B.氯气氧化绿矾
C.绿矾具有净水作用
D.绿矾的氧化产物具有净水作用
难度: 简单查看答案及解析
-
下列物质不能用作食品干燥剂的是( )
A.硅胶 B.六水合氯化钙
C.碱石灰 D.具有吸水性的植物纤维
难度: 中等查看答案及解析
-
证明溴乙烷与NaOH醇溶液共热发生的是消去反应,分别设计甲、乙、丙三个实验:(甲)向反应混合液中滴入溴水,溶液颜色很快褪去.(乙)向反应混合液中滴入过量稀硝酸,再滴入AgNO3溶液,有浅黄色沉淀生成.(丙)向反应混合液中滴入酸性KMnO4溶液,溶液颜色褪去.则上述实验可以达到目的是( )
A.甲 B.乙 C.丙 D.都不行
难度: 中等查看答案及解析
-
对于1mol/L盐酸与铁片的反应,下列措施不能使产生H2反应速率加快的是( )
A.加入一小块铜片 B.改用等体积 98%的硫酸
C.用等量铁粉代替铁片 D.改用等体积3mol/L盐酸
难度: 中等查看答案及解析
-
已知酸性溶液中还原性的顺序为SO32->I->Fe2+>Br->Cl-,下列反应不能发生的是
A.2Fe3++SO32-+H2O→2Fe2++SO42-+2H+ B.I2+ SO32-+H2O→SO42-+2I-+2H+
C.2Fe2++I2→2Fe3++2I- D.Br2+SO32-+H2O→SO42-+2Br-+2H+
难度: 中等查看答案及解析
-
不能判断甲比乙非金属性强的事实是()
A.常温下甲能与氢气直接化合,乙不能
B.甲的氧化物对应的水化物酸性比乙强
C.甲得到电子能力比乙强
D.甲、乙形成的化合物中,甲显负价,乙显正价
难度: 简单查看答案及解析
-
有3份等量的烧碱溶液,第1份直接与盐酸反应;第2份稀释一倍,再与盐酸反应;第3份通入适量的CO2后,再与盐酸反应.若盐酸的浓度相同,完全反应时消耗盐酸的体积分别为V1、V2和V3,则V1、V2和V3的大小关系正确的是( )
A.V1=V2=V3 B.V1>V3>V2 C.V2>V3>V1 D.V1>V2>V3
难度: 中等查看答案及解析
-
下列我国古代技术应用中,其工作原理不涉及化学反应的是( )
A.黑火药爆炸 B.用铁矿石炼铁 C.湿法炼铜 D.转轮排字
难度: 简单查看答案及解析
-
下列关于自然界中氮循环示意图(如图)的说法错误的是( )
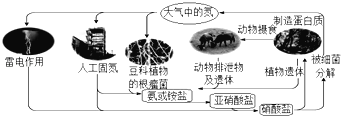
A.氮元素只被氧化
B.豆科植物根瘤菌固氮属于自然固氮
C.其它元素也参与了氮循环
D.含氮无机物和含氮有机物可相互转化
难度: 简单查看答案及解析
-
如图是电解饱和食盐水(含少量酚酞)的装置,其中c、d为石墨电极。下列说法正确的是
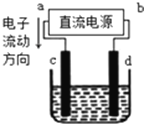
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,钠离子浓度不变
D.电解过程中,d电极附近变红
难度: 简单查看答案及解析
-
分枝酸可用于生化研究,其结构简式如图。下列说法正确的是
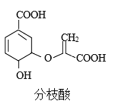
A.分子中含有3种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
难度: 简单查看答案及解析
-
实现化学能转变为电能的装置是( )
A.
 干电池 B.
干电池 B. 电解水
电解水C.
 太阳能热水器 D.
太阳能热水器 D. 水力发电
水力发电难度: 中等查看答案及解析
-
如图是N2(g)+3H2(g)
2NH3(g)在反应过程中的反应速率v与时间(t)的关系曲线,下列说法错误的是( )
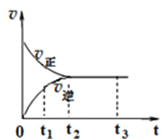
A.t1时,正方向速率大于逆反应速率
B.t2时,反应体系中NH3的浓度达到最大值
C.t2﹣t3时间段,正反应速率等于逆反应速率
D.t2﹣t3时间段,各物质的浓度相等且不再发生变化
难度: 简单查看答案及解析
-
某稀硫酸和稀硝酸混合溶液100 mL,逐渐加入铁粉,产生气体的量随铁粉加入量的变化如图所示。下列说法错误的是( )

A.H2SO4浓度为4 mol/L
B.溶液中最终溶质为FeSO4
C.原混合酸中NO3-浓度为0.2 mol/L
D.AB段反应为:Fe+2Fe3+=3Fe2+
难度: 困难查看答案及解析
-
用如图装置进行实验,甲逐滴加入到固体乙中,如表说法正确的是( )
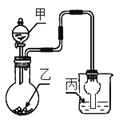
选项
液体甲
固体乙
溶液丙
丙中现象
A
CH3COOH
NaHCO3
苯酚钠
无明显现象
B
浓HCl
KMnO4
紫色石蕊
最终呈红色
C
浓H2SO4
Na2SO3
品红
红色变无色
D
浓H2SO4
Cu
氢硫酸
溶液变浑浊
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
如图是CO2生产甲醇的能量变化示意图.下列说法正确的是( )
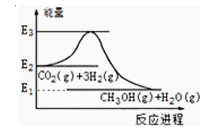
A.E2_E1是该反应的热效应
B.E3_E1是该反应的热效应
C.该反应放热,在常温常压下就能进行
D.实现变废为宝,且有效控制温室效应
难度: 简单查看答案及解析
-
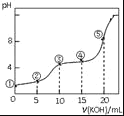
将NaHCO3和Na2O2的固体混合物x g在密闭容器中加热至250℃,充分反应后排出气体.将反应后的固体溶入水无气体放出,再逐滴加入盐酸,产生气体(标准状况)与所加盐酸体积之间的关系如图所示.下列说法错误的是( )
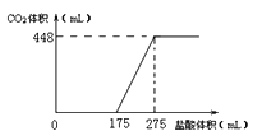
A.HCl的浓度0.2mol/L
B.反应后固体的成分为NaOH与Na2CO3
C.密闭容器中排出气体的成分为O2和H2O
D.x的数值为6.09
难度: 中等查看答案及解析

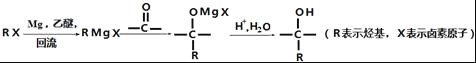
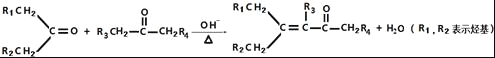
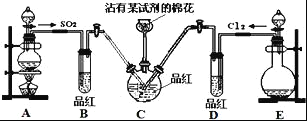
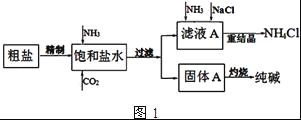
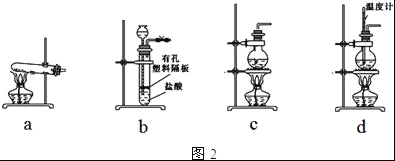
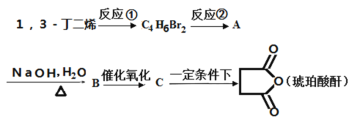
 )________________
)________________